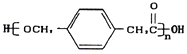
题目内容
【题目】利用“五室电渗析法”处理含硫酸钠废水的原理如图所示,以石墨为电极材料,室与室之间用离子交换膜分开(阳膜和阴膜分别只允许阳离子、阴离子通过),下列说法不正确的是 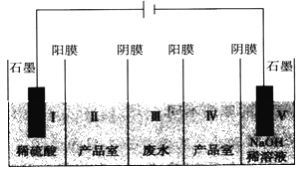
A. 阳极反应式为2H2O-4e-==O2↑+4H+,发生氧化反应
B. 通电片刻后,I、III、V室的pH依次减小、不变、增大
C. 当电路中通过1mol电子时,有1molSO42-从III室进入Ⅱ室
D. 总反应式为Na2SO4+4H2O![]() 2NaOH+H2SO4+O2↑+2H2↑
2NaOH+H2SO4+O2↑+2H2↑
【答案】C
【解析】A. 阳极上溶液中的水放电,发生氧化反应,电极反应式为2H2O-4e-=O2↑+4H+,故A正确;B. 通电片刻后,I中生成氢离子,溶液的pH减小;III中的阴阳离子分别向Ⅱ和Ⅳ移动,硫酸钠的浓度减小,溶液仍呈中性,pH不变;V室中阴极上溶液中的水放电,发生还原反应,2H2O+2e- = H2↑+ 2OH―,溶液的pH增大,故B正确;C. 根据得失电子守恒和溶液的电荷守恒,当电路中通过1mol电子时,有0.5molSO42-从III室进入Ⅱ室,故C错误;D. 根据A和B的分析,该电解装置的总反应式为Na2SO4+4H2O![]() 2NaOH+H2SO4+O2↑+2H2↑,故D正确;故选C。
2NaOH+H2SO4+O2↑+2H2↑,故D正确;故选C。

 阅读快车系列答案
阅读快车系列答案【题目】由下列实验及现象得出的结论正确的是
实验 | 现象 | 结论 | |
A | SO2与H2S气体混合 | 产生淡黄色沉淀 | 氧化性:SO2>S |
B | 向盛有FeSO4溶液的试管中滴入氯水,然后滴入KSCN溶液 | 滴入KSCN后溶液变为红色 | 原FeSO4溶液已被空气中O2氧化变质 |
C | 试管中盛有Cu(NO3)2溶液,底部有少量铜,向其中加入稀硫酸 | 铜粉逐渐溶解 | 铜可与稀硫酸反应 |
D | 向2支盛有2mL相同浓度的NaOH溶液的试管中分别滴入2滴相同浓度的AlCl3和MgCl2溶液,振荡并静置 | 前者无沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A. A B. B C. C D. D