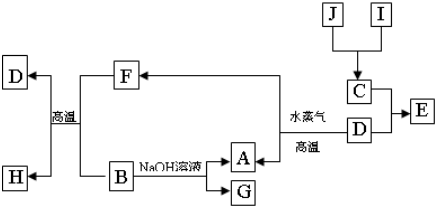
题目内容
①CH3COONa
②CuCl2
(2)今有a?盐酸 b?硫酸 c?醋酸三种酸:在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是
②氯化铜是强酸弱碱盐,铜离子水解显酸性;
(2)在同体积,同pH的三种酸中氢离子物质的量相同,盐酸和硫酸是强酸,溶液中氢离子物质的量相同,醋酸是弱电解质存在电离平衡,随反应进行继续电离出氢离子,随反应进行过程中溶液中氢离子物质的量大于盐酸和硫酸;
故答案为:CH3COO-+H2O?CH3COOH+OH-;碱;
②氯化铜是强酸弱碱盐,铜离子水解,离子方程式为:Cu2++2H2O?Cu(OH)2+2H+;溶液呈酸性;
故答案为:Cu2++2H2O?Cu(OH)2+2H+; 酸.
(2)在同体积,同pH的三种酸中氢离子物质的量相同,盐酸和硫酸是强酸,溶液中氢离子物质的量相同,与足量的碳酸钠粉末反应生成二氧化碳相等;醋酸是弱电解质存在电离平衡,随反应进行继续电离出氢离子,随反应进行过程中溶液中氢离子物质的量大于盐酸和硫酸,生成二氧化碳气体大于盐酸和硫酸;
故答案为:c>b=a

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去。
该学生为了了解该过程的原因,进行了下列探究过程:
【实验探究】
实验1: 加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
|
温度(℃) |
10 |
20 |
30 |
50 |
70 |
80 |
100 |
|
pH |
8.3 |
8.4 |
8.5 |
8.9 |
9.4 |
9.6 |
10.1 |
实验2:10℃时,在烧杯中加入0.1mol/LNaHCO3溶液200mL,测得该溶液pH=8.3,加热到100℃,测得pH=10.2,恢复到10℃,pH=9.8。
实验3:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊。
实验4:
①配制0.1mol/LNaHCO3溶液和0.1mol/LNa2CO3溶液各200mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5。
②加热蒸发0.1mol/L NaHCO3溶液200mL,至溶液体积100mL,停止加热,加水至200mL,冷却至原温度,测得溶液pH=9.8。
③将0.1mol/L NaHCO3溶液200mL敞口放置三天,再加水至200mL,测得溶液pH=10.1。
请根据上述实验回答下列问题:
(1)用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)___________
________________、_______________________________。这两个平衡以_______________
为主,理由是_______________________________.
(1)实验3得到的结论是__________________________________________________。
(1)结合实验2、3分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是_____________
__________、______________________、________________________________。
(1)实验4①得到的结论是_______________________________________________。
(1)实验4②“加水至200mL”的目的是____________________________________________。
实验4③可以得到的结论是_______________________________________。
(1)要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是________________。
 Al(OH)3+OH-
Al(OH)3+OH-