题目内容
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:
CO(NH2)2+2NaOH+NaC1O==N2H4·H2O+Na2CO3+NaCl。

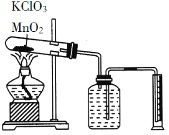
实验1:制备NaClO溶液。(已知:3NaClO![]() 2NaCl+NaClO3)
2NaCl+NaClO3)
(1)图甲装置I中烧瓶内发生反应的化学方程式为_______________________。
(2)用NaOH固体配制溶质质量分数为30%NaOH溶液时,所需玻璃仪器除量筒外还有________________。(填标号)
a.烧杯 b.容量瓶 c.玻璃棒 d.烧瓶
(3)图甲装置Ⅱ中用冰水浴控制温度的目的是_________________。
实验2:制取水合肼。
(4)图乙中若分液漏斗滴液速度过快,部分N2H4·H2O会参与A中反应并产生大量氮气,降低产品产率。写出该过程反应生成氮气的化学方程式:________________________。充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量。
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15 mol·L-1的碘的标准溶液滴定。(已知:N2H4·H2O+2I2==N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在________(填“酸式”或“碱式”)滴定管。
②下列能导致馏分中水合肼的含量测定结果偏高的是_________。(填标号)
a.锥形瓶清洗干净后未干燥
b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视
d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为_______________________。
【答案】 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O ac 防止NaClO分解,影响水合肼的产率 N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl 酸式 d 25%
MnCl2+Cl2↑+2H2O ac 防止NaClO分解,影响水合肼的产率 N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl 酸式 d 25%
【解析】(1)二氧化锰与浓盐酸反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-![]() Mn2+Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2+Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2+Cl2↑+2H2O;
Mn2+Cl2↑+2H2O;
(2)配制30%NaOH溶液时,用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒,故答案为:ac;
(3)由于温度升高时,次氯酸钠容易发生自身的氧化还原反应生成氯酸钠和氯化钠,所以步骤1温度需要在30℃以下,其主要目的是防止NaClO(歧化)分解为氯酸钠和氯化钠,故答案为:防止NaClO(歧化)分解,影响水合肼的产率;
(4)N2H4H2O具有强还原性,容易被过量的NaClO氧化,会发生反应:N2H4H2O+2NaClO=N2↑+3H2O+2NaCl,故答案为:N2H4H2O+2NaClO=N2↑+3H2O+2NaCl;
(5)①碘的标准溶液显酸性,应该盛放在酸式滴定管中,故答案为:酸式;
②a.锥形瓶清洗干净后未干燥,对实验结果无影响,错误;b.滴定前,滴定管内无气泡,滴定后有气泡,导致标准液的体积偏小,则结果偏低,错误;c.读数时,滴定前平视,滴定后俯视,导致滴定后读数偏小,使得标准液的体积偏小,则结果偏低,错误;d.盛标准液的滴定管水洗后,直接装标准液,使得标准液的浓度偏小,造成滴定后标准液的体积偏大,则结果偏高,正确;故选d;
③设馏分中水合肼(N2H4H2O)的质量分数为a,则:
N2H4H2O+2I2=N2↑+4HI+H2O
50g 2mol
0.3000g×a 0.020L×0.15mol/L
所以50g:0.3000g×a=2mol:0.020L×0.15mol/L,解得:a=25%,故答案为:25%。

 阅读快车系列答案
阅读快车系列答案【题目】下列有关反应热的叙述中正确的是( )
①下表数据可以计算出 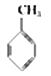 (g)+3H2(g)→
(g)+3H2(g)→ 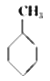 (g)的反应热;
(g)的反应热;
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
②已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1, 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
③由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
④X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A. ①②③④ B. ③④⑤ C. ④⑤ D. ⑥
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生的反应类型和反应条件都正确的是( )
选项 | 反应类型 | 反应条件 |
A | 加成反应、取代反应、消去反应 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
C | 氧化反应、取代反应、消去反应 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D