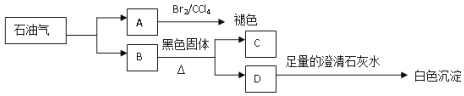
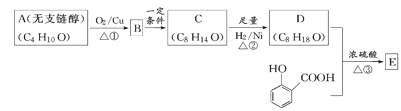
题目内容
【题目】下列有关电化学的内容正确的是
A.马口铁和白铁皮破损后,白铁皮比马口铁腐蚀快,所以使用白铁皮时要注意防止铁皮出现刮痕
B.原电池中电子从负极流出流入正极,电解池中电子从阴极流出流入电源负极
C.已知磷酸亚铁锂电池总反应为FePO4+ Li![]() LiFePO4,电池中的固体电解质可传导Li+,则该电池充电时阳极电极反应式为:LiFePO4-e-=FePO4+Li+
LiFePO4,电池中的固体电解质可传导Li+,则该电池充电时阳极电极反应式为:LiFePO4-e-=FePO4+Li+
D.常温下以C选项中电池为电源以石墨为电极电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为13(忽略溶液的体积变化)
【答案】C
【解析】
A.马口铁和白铁皮破损后,由于白铁皮表面有活动性比Fe强的Zn,马口铁表面有活动性比Fe弱的Sn,所以都会构成原电池,前者首先被腐蚀的是Zn,后者Fe先被腐蚀,因此Fe被腐蚀的速率后者大于前者。使用白铁皮时铁皮出现刮痕也同样会对铁起到保护作用,错误;
B.原电池中电子从负极流出流入正极,电解池中电子从电源负极流出流入阴极,再从阳极流出流入电源正极,错误;
C.已知磷酸亚铁锂电池总反应为FePO4+ Li![]() LiFePO4,电池中的固体电解质可传导Li+,则该电池充电时阴极电极反应式为:LiFePO4-e-=FePO4+Li+,正确;
LiFePO4,电池中的固体电解质可传导Li+,则该电池充电时阴极电极反应式为:LiFePO4-e-=FePO4+Li+,正确;
D.常温下以C选项中电池为电源以石墨为电极电解200mL饱和食盐水,由于在整个闭合回路中电子转移的数目相等,当消耗1.4g Li时,n(e-)=1.4g÷7g/mol=0.2mol,则在NaCl溶液中发生反应2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH ,产生NaOH的物质的量是0.2mol,由于溶液的体积是0.2L,所以c(NaOH)=1mol/L,根据在室温下水的离子积常数是1×10-14,可得溶液的pH为14,错误。
Cl2↑+H2↑+2NaOH ,产生NaOH的物质的量是0.2mol,由于溶液的体积是0.2L,所以c(NaOH)=1mol/L,根据在室温下水的离子积常数是1×10-14,可得溶液的pH为14,错误。
故选C。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目