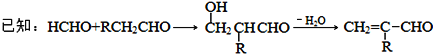
题目内容
【题目】常温下,向1LpH=10的NaOH溶液中持续通入CO2,通入的CO2体积(V)与溶液中水电离出的OH-离子浓度的关系如图所示。下列叙述不正确的是( )
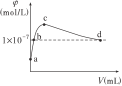
A.a点溶液中:水电离出的c(H+)=1×10-10mol·L-1
B.b点溶液中:c(H+)=1×10-7mol·L-1
C.c点溶液中:c(Na+)>c(CO32-)>c(HCO3-)
D.d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-)
【答案】B
【解析】
A. a点溶液为1LpH=10的NaOH溶液,溶液中氢离子浓度为1×10-10mol·L-1,就是水电离出的,故正确;
B. b点溶液为氢氧化钠和碳酸钠,水电离的氢氧根离子浓度为1×10-7mol·L-1,但溶液中还有氢氧化钠电离出的氢氧根离子,所以根据水的离子积常数计算,溶液中的c(H+)不为1×10-7mol·L-1,故错误;
C. c点溶液中水电离出的氢氧根离子浓度最大,说明溶液为碳酸钠,根据碳酸根水解分析,溶液中离子浓度关系为:c(Na+)>c(CO32-)>c(HCO3-),故正确;
D. d点溶液为碳酸氢钠和碳酸的混合液,此时溶液呈中性,电荷守恒为c(Na+) +c(H+)=2c(CO32-)+c(HCO3-)+ c(OH-),c(OH-)= c(H+)=1×10-7mol·L-1,则:c(Na+)=2c(CO32-)+c(HCO3-),故正确。
故选B。

【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.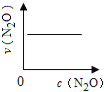 B.
B.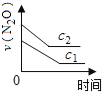 C.
C.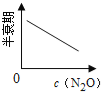 D.
D.