题目内容
【题目】为了测定碳酸氢钠中杂质氯元素(离子状态)的含量,先称取ag试样用蒸馏水溶解,再用足量稀硝酸酸化,配成100mL溶液,取出20mL注入锥形瓶中,然后用cmol·L-1AgNO3标准溶液滴定Cl-,K2CrO4溶液为指示剂。
已知:常温下Ksp(AgCl)=2×10-10,Ksp(Ag2CrO4)=1.12×10-12,Ag2CrO4为砖红色。
(1)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):___;
(2)当Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5mol·L-1,则此时溶液中的c(CrO![]() )为___mol·L-1。
)为___mol·L-1。
(3)滴定过程中,使用棕色滴定管的原因是___;
(4)当最后一滴AgNO3滴入,___停止滴定。
(5)若此时消耗了AgNO3标准溶液VmL,则碳酸氢钠样品中杂质氯元素的质量分数表达式为___。
(6)下列情况会造成实验测定结果偏低的是___。
a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
【答案】酸 Ag++H2O![]() AgOH+H+ 2.8×10-3 防止硝酸银见光分解 出现砖红色沉淀且在半分钟内不再消失时
AgOH+H+ 2.8×10-3 防止硝酸银见光分解 出现砖红色沉淀且在半分钟内不再消失时 ![]() c
c
【解析】
(1)Ag+对应的碱为AgOH,属于弱碱,故Ag+在水中会发生水解:Ag++H2O![]() AgOH+H+,导致溶液呈酸性,故答案为:酸;Ag++H2O
AgOH+H+,导致溶液呈酸性,故答案为:酸;Ag++H2O![]() AgOH+H+;
AgOH+H+;
(2)由氯化银与铬酸银的溶度积可知,氯化银的溶解度小于铬酸银,所以当Cl-恰好沉淀完全时,铬酸银正好开始沉淀,则溶液中银离子浓度为2×10-10mol/L÷1×10-5mol/L=2×10-5mol/L,此时溶液中的c(CrO42-)=(1.12×10-12)÷(2×10-5)2=2.8×10-3mol·L-1,故答案为:2.8×10-3;
(3)由于硝酸银见光分解,使用棕色滴定管的原因是防止硝酸银见光分解,故答案为:防止硝酸银见光分解;
(4)当Cl-恰好沉淀完全时,铬酸银正好开始沉淀,停止滴定,所以当观察到出现砖红色沉淀且在半分钟内不再消失时停止滴定,故答案为:出现砖红色沉淀且在半分钟内不再消失时;
(5)根据题给信息,滴定时发生的反应为Cl-+Ag+=AgCl↓,消耗了AgNO3标准溶液V mL时,n(AgNO3)=cV×10-3mol,则碳酸氢钠样品中杂质氯元素的质量分数表达式为![]() ,故答案为:
,故答案为:![]() ;
;
③a. 盛放AgNO3溶液的滴定管水洗后未用标准液润洗,硝酸银的浓度减小,滴定时所需硝酸银的体积增大,会造成实验测定结果偏高,a错误;
b.滴定管滴定前尖嘴部分有气泡,滴定后消失,使读出的硝酸银的体积增大,造成实验测定结果偏高,b错误;
c.滴定前仰视读数,滴定后俯视读数,使读出的硝酸银的体积减小,造成实验测定结果偏低,c正确;
故答案为:c。

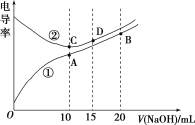
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2