题目内容
11.(1)0.3mol H2O分子中所含氢原子数与1.204×1024个NH3分子中所含氢原子数相等.(2)将质量比为14:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为1:1,氮原子和氧原子的个数比为3:1,该混合气体的平均摩尔质量为29g/mol.
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,那么c g氧气在标准状况下的体积约是$\frac{22.4bc}{a{N}_{A}}$L(用含NA的式子表示).
(4)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,写出反应的离子方程式H++SO42-+HCO3-+Ba2+=H2O+CO2↑+BaSO4↓.在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为H++HCO3-=H2O+CO2↑.
分析 (1)氢原子数目相等,则H原子物质的量相等,结合分子式计算氨气物质的量,再根据N=nNA计算氨气分子数目;
(2)根据n=$\frac{m}{M}$计算N2和NO的物质的量之比,结合分子式计算N、O原子数目之比,根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均摩尔质量;
(3)计算cg氧气含有分子数目,再根据n=$\frac{N}{{N}_{A}}$计算氧气物质的量,根据V=nVm计算氧气体积;
(4)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,二者按物质的量1:1进行反应生成硫酸钡沉淀与碳酸氢钠、水、二氧化碳;
在上述溶液中继续滴入NaHSO4溶液,此时碳酸氢根离子与氢离子反应生成二氧化碳与水.
解答 解:(1)与0.3mol H2O分子所含氢原子数相等的NH3分子物质的量为$\frac{0.3mol×2}{3}$=0.2mol,故氨气分子数目为0.2mol×6.02×1023mol-1=1.204×1024,
故答案为:1.204×1024;
(2)质量比为14:15的N2和NO的物质的量之比为$\frac{14g}{28g/mol}$:$\frac{15g}{30g/mol}$=1:1,混合气体中N、O原子数目之比为(1×2+1):1=3:1,平均摩尔质量=$\frac{1mol×28g/mol+1mol×30g/mol}{1mol+1mol}$=29g/mol,
故答案为:1:1;3:1;29g/mol;
(3)cg氧气含有分子数目为b×$\frac{c}{a}$,氧气物质的量为$\frac{\frac{bc}{a}}{{N}_{A}mo{l}^{-1}}$=$\frac{bc}{a{N}_{A}}$mol,故标况下氧气体积为$\frac{bc}{a{N}_{A}}$mol×22.4L/mol=$\frac{22.4bc}{a{N}_{A}}$L,
故答案为:$\frac{22.4bc}{a{N}_{A}}$L;
(4)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,二者按物质的量1:1进行反应生成硫酸钡沉淀与碳酸氢钠、水、二氧化碳,反应离子方程式为:H++SO42-+HCO3-+Ba2+=H2O+CO2↑+BaSO4↓,在上述溶液中继续滴入NaHSO4溶液,此时碳酸氢根离子与氢离子反应生成二氧化碳与水,反应离子方程式为:H++HCO3-=H2O+CO2↑,
故答案为:H++SO42-+HCO3-+Ba2+=H2O+CO2↑+BaSO4↓;H++HCO3-=H2O+CO2↑.
点评 本题考查物质的量有关计算、离子方程式书写,(4)中关键是根据沉淀完全判断发生的反应.

| A. | 1 mol H2O 的质量为18g/mol | |
| B. | CH4 的摩尔质量为16g | |
| C. | 3.01×1023 个SO2 分子的质量为32g | |
| D. | 标准状况下,1 mol 任何物质的体积均为22.4L |
| A. |  (2-乙基戊烷) (2-乙基戊烷) | B. | 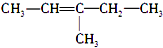 (3-甲基-2-戊烯) (3-甲基-2-戊烯) | ||
| C. | 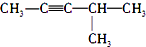 (2-甲基-戊炔) (2-甲基-戊炔) | D. | 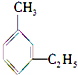 (1-甲基-5-乙基苯) (1-甲基-5-乙基苯) |
| 实验操作 | 结论 | |
| A | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失 | 一定含有SO42- |
| B | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中溶液变浑浊 | 可能含有HCO3- |
| C | 加入NaOH溶液有白色沉淀生成 | 一定含有Al3+ |
| D | 用四氯化碳萃取某溶液时,分层且下层显紫红色 | 一定含有碘单质 |
| A. | A | B. | B | C. | C | D. | D |
| A. | ①② | B. | ②④ | C. | ①⑤ | D. | ③④ |
| A. | 果糖 | B. | 氨基酸 | C. | 油脂 | D. | 葡萄糖 |
 工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去.如图为电解装置示意图(电极材料分别为铁和石墨):
工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去.如图为电解装置示意图(电极材料分别为铁和石墨): 将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答: