题目内容
16. 工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去.如图为电解装置示意图(电极材料分别为铁和石墨):
工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去.如图为电解装置示意图(电极材料分别为铁和石墨):(1)装置中的b电极是阳极(填“阳极”或“阴极”).
(2)a电极的电极反应式是2H++2e-=H2↑.
(3)完成b电极附近溶液中反应的离子方程式:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(4)电解结束后,若要检验电解液中还有Fe2+存在,可选用的试剂是D(填字母).
A.KSCN溶液 B.CuCl2溶液 C.H2O2溶液 D.K3[Fe(CN)6].
分析 Cr2O72-具有强氧化性,将Cr2O72-转化成Cr(OH)3沉淀需要还原剂,Fe作阳极,该电极上Fe失电子生成Fe2+,Fe2+具有还原性,能还原将Cr2O72-转化成Cr3+,同时自身被还原生成Fe3+,所以a电极材料是石墨、b电极材料是Fe;
(1)连接原电池负极的电极是阴极、连接原电池正极的电极是阳极;
(2)阴极上氢离子放电生成氢气;
(3)b电极上Fe失电子生成Fe2+,亚铁离子具有还原性,b电极附近Fe2+和Cr2O72-发生氧化还原反应Cr3+、Fe3+;
(4)亚铁离子可以用高锰酸钾溶液、K3[Fe(CN)6]检验.
解答 解:Cr2O72-具有强氧化性,将Cr2O72-转化成Cr(OH)3沉淀需要还原剂,Fe作阳极,该电极上Fe失电子生成Fe2+,Fe2+具有还原性,能还原将Cr2O72-转化成Cr3+,同时自身被还原生成Fe3+,所以a电极材料是石墨、b电极材料是Fe;
(1)连接原电池负极的电极是阴极、连接原电池正极的电极是阳极,所以a是阴极、b是阳极,
故答案为:阳极;
(2)阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)b电极上Fe失电子生成Fe2+,亚铁离子具有还原性,b电极附近Fe2+和Cr2O72-发生氧化还原反应Cr3+、Fe3+,同时有水生成,Cr元素化合价由+6价变为+3价、Fe元素化合价由+2价变为+3价,转移电子数为6,结合电荷守恒、原子守恒配平方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr3+; Fe3+;H2O;
(4)酸性高锰酸钾溶液能被亚铁离子还原而使酸性高锰酸钾溶液褪色,亚铁离子和铁氰化钾反应生成蓝色沉淀,所以亚铁离子可以用高锰酸钾溶液、K3[Fe(CN)6]检验,故选D.
点评 本题考查电解原理,为高频考点,涉及电极反应式的书写、氧化还原反应、氧化还原反应方程式的配平、离子检验等知识点,明确物质性质、离子检验方法和现象即可解答,题目难度不大.

| A. | 标准状况下22.4LH2O中含分子数为NA | |
| B. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | 常温常压下,1mol氦气含有2NA个原子 | |
| D. | 1molHCl气体溶于1L水中形成的盐酸中含有NA个HCl分子 |
| A. | 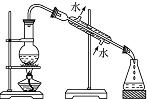 制取少量蒸馏水 制取少量蒸馏水 | B. | 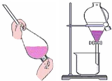 分离酒精与水 | C. | 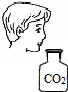 闻CO2的味道 | D. | 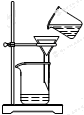 过滤沉淀 |
| 所含离子 | NO${\;}_{3}^{-}$ | SO${\;}_{4}^{2-}$ | H+ | Na+ | Mn+ |
| 浓度(mol/L) | 3 | 1 | 2 | 1 | a |
| A. | Mg2+、1 | B. | Ba2+、0.5 | C. | Al3+、1.5 | D. | Fe2+、2 |
| A. | 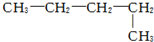 戊烷 戊烷 | B. | 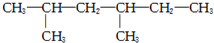 2,4-甲基乙烷 2,4-甲基乙烷 | ||
| C. | 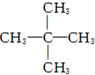 2,2-二甲基丙烷 2,2-二甲基丙烷 | D. |  4-甲基戊烷 4-甲基戊烷 |
| A. | 标准状况下,0.56L丙烷中含有共价键的数目为2.5NA | |
| B. | 常温常压下,6.4g氧气和臭氧的混合气体中含有的原子总数为0.4NA | |
| C. | 5.6g铁与一定量浓硫酸恰好反应,转移的电子数目可能为0.2NA | |
| D. | 常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |