题目内容
3.下列物质中,所含分子数相等的是( )①4℃时7.2ml水 ②14.7gH2SO4 ③8.4gN2 ④0.3gH2.
| A. | ①② | B. | ②④ | C. | ①④ | D. | ③④ |
分析 根据m=ρV计算水的质量,再根据n=$\frac{m}{M}$计算各物质的物质的量,物质的量相等则含有分子数目相等.
解答 解:①4℃时7.2ml水的质量为7.2mL×1g/mol=7.2g,其物质的量$\frac{7.2g}{18g/mol}$=0.4mol;
②14.7gH2SO4 $\frac{14.7g}{98g/mol}$=0.15mol;
③8.4gN2 的物质的量为$\frac{8.4g}{28g/mol}$=0.3mol;
④0.3gH2的物质的量为$\frac{0.3g}{2g/mol}$=0.15mol,
故选:B.
点评 本题考查物质的量有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
14.下列有关说法不正确的是( )
| A. | 物质的量表示含有一定数目粒子的集合体 | |
| B. | 物质的量是联系微观粒子和宏观物质的物理量 | |
| C. | 0.012kg 12C中所含碳原子数约为6.02×1023 | |
| D. | 物质的量可用于表示宏观物质的多少 |
11.在H、O、C、Na四种元素中,选择适当的元素组成符合如表要求的物质,将它们的化学式填写在空格中.
| 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 正盐 | 酸式盐 |
| CO2 | Na2O | H2CO3 | NaOH | Na2CO3 | NaHCO3 |
18.下列表示对应的化学反应的离子方程式正确的是( )
| A. | FeO溶于稀硝酸:FeO+2H++NO3-=Fe3++NO↑+H2O | |
| B. | 氯化氢气体通入澄清石灰水中:HCl+OH-=H2O+Cl- | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:2Ba2++OH-+H++2SO42-=2BaSO4↓+H2O | |
| D. | 在溶液中,氯化铝与烧碱按物质的量之比1:1混合:Al3++3OH-=Al(OH)3↓ |
8.下列各组液体,能用分液的方法将它们分离的是( )
| A. | 水和醋酸 | B. | 溴和水 | C. | 水和植物油 | D. | 猪油和汽油 |
15.下列表示物质或微粒的化学用语或模型正确的是( )
| A. | 氮气分子的结构式:N-N | B. | Mg2+的结构示意图: | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 二氧化碳电子: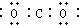 |
12.利用下述操作步骤:①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加盐酸生成Al(OH)3沉淀,由含少量铁粉的铝粉制取纯净的氢氧化铝,最恰当的组合是( )
| A. | ②③④③ | B. | ②③⑤③ | C. | ①③④③ | D. | ②⑤③④ |
13.25℃时,在强碱性溶液中可以大量共存的离子组是( )
| A. | K+、Cu2+、SO32-、MnO4- | B. | NH4+、Fe2+、NO3-、H+ | ||
| C. | HCO3-、Na+、Mg2+、Cl- | D. | Na+、K+、SO42-、Cl- |