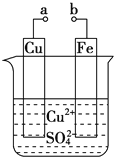
题目内容
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
【答案】A
【解析】将适量铁粉放入FeCl3溶液中,完全反应,发生的反应为:Fe+2Fe3+=3Fe2+,已反应的Fe3+的物质的量为x,则
Fe+2Fe3+=3Fe2+
2 3
x 1.5x
溶液中的Fe3+和Fe2+浓度相等,所以,未反应的Fe3+的物质的量为1.5x,所以已反应的Fe3+和未反应的Fe3+的物质的量之比=x:1.5x=2:3,故选A。

【题目】2SO2(g)+ O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 |
A. 甲中反应的平衡常数小于乙
B. 该温度下,平衡常数值为400
C. 平衡时,丙中c(SO3)是甲中的2倍
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0