题目内容
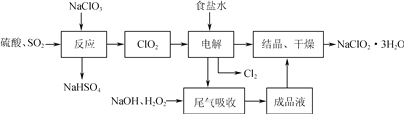
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白和杀菌,其一种生产工艺流程如下:
回答下列问题:
(1) 写出“反应”步骤中生成ClO2的化学方程式:________________________。
(2) “电解”所用食盐水由粗盐水精制而成,精制时为除去Mg2+和Ca2+,要加入的试剂分别为___________________、___________________。
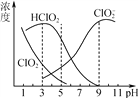
(3) 亚氯酸钠(NaClO2)在水溶液中可生成ClO2、HClO2、ClO![]() 、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
(4) 为了测定NaClO2·3H2O的纯度,取上述合成产品10.00 g溶于水配成1000 mL溶液,取出20.00 mL溶液于锥形瓶中,再加入足量硫酸酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.2640 mol·L-1Na2S2O3标准溶液滴定,共用去Na2S2O3标准溶液20.00 mL,通过计算确定该产品纯度是否合格?(合格纯度在90%以上)(写出计算过程)__________
提示: 2Na2S2O3+I2===Na2S4O6+2NaI。
【答案】2NaClO3+SO2+H2SO4===2NaHSO4+2ClO2NaOHNa2CO3小于NaClO2·3H2O~2I2~4Na2S2O3
n(NaClO2·3H2O)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.264 0 mol·L-1 ×0.02L
×0.264 0 mol·L-1 ×0.02L
=1.32×10-3 mol (2分)
则10.00 g样品中NaClO2·3H2O总质量为:
m(NaClO2·3H2O)总=1.32×10-3 mol×144.5 g·mol-1×![]()
=9.537 g (1分)
产品的纯度为![]() ×100%=95.37%>90%
×100%=95.37%>90%
所以该产品为合格产品。(1分)
【解析】本题考查化学工艺流程,涉及反应方程式的书写、物质的除杂和提纯、化学计算等知识,(1)生成ClO2时,需要的反应物是H2SO4、SO2、NaClO3,产物是NaHSO4、ClO2,可以写成NaClO3+SO2+H2SO4→NaHSO4+ClO2↑,NaClO3中Cl的化合价由+5价→+4价,化合价降低1价,SO2中S的化合价由+4价→+6价,化合价升高2价,最小公倍数为2,即NaClO3、ClO2的系数为2,2NaClO3+SO2+H2SO4→NaHSO4+2ClO2↑,根据原子守恒,NaHSO4的系数为2,反应方程式为:2NaClO3+SO2+H2SO4===2NaHSO4+2ClO2;(2)除去杂质,不能引入新的杂质,除去Mg2+用NaOH溶液,除去Ca2+,用Na2CO3溶液;(3)选择适宜的pH,应是ClO2-的浓度最小,即pH<3;(4)根据得失电子数目守恒,n(NaClO2·3H2O)×4=n(I2)×2,建立的关系式为:NaClO2·3H2O~2I2,根据已知信息,建立NaClO2·3H2O和Na2S2O3的关系式NaClO2·3H2O~2I2~4Na2S2O3,10.00g样品中NaClO2·3H2O的质量为20×10-3×0.264×144.5×1000/(20×4)g=9.537g,产品纯度是9.537/10×100%=95.37%>90%,因此产品合格。