题目内容
7.下表是元素周期表的一部分,回答下列有关问题:族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ⑬ | |||||||
| 2 | ① | ⑭ | ② | |||||
| 3 | ③ | ④ | ⑥ | ⑤ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:④
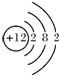 ,⑥
,⑥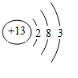 ,⑧
,⑧ .
.(3)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
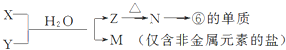
X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,
(6)在③与④中,化学性质较活泼的是Na,怎样用化学实验证明?
答:与水反应;
在⑧与⑫中,化学性质较活泼的是Cl2,请用化学方程式来说明.
答:Cl2+2NaBr=2NaCl+Br2.
分析 由元素周期表中各种物质所在的周期与族序数得知:①是氮,②是氟,③是钠,④是镁,⑤是硅,⑥是铝,⑦是硫,⑧是氯,⑨是氩,⑩是钾,⑪是钙,⑫是溴,⑬是氢,⑭是氧元素,
(1)依据推断得出各种元素的元素符号;
(2)④号元素的原子序数是12,⑥号元素的原子序数是13,⑧号元素的原子序数是17,据此画出原子结构示意图即可;
(3)金属元素IA族的原子序数越大,越活泼,非金属中VIIA族的原子序数越小越活泼,稀有气体最不活泼,据此解答即可;
(4)元素的非金属性越强,其对应最高价氧化物水化物的酸性越强,金属性越强,其对应最高价氧化物的水化物的碱性越强;
(5)M为仅含非金属元素的盐,则M为铵盐,元素⑥的单质为Al,可推知N为氧化铝、Z为氢氧化铝,电解熔融氧化铝得到Al与氧气,故X溶液与Y溶液是铝盐与氨水发生的反应,据此解答;
(6)根据元素金属性强弱和非金属性强弱的判断方法思考.
解答 解:①是氮,②是氟,③是钠,④是镁,⑤是硅,⑥是铝,⑦是硫,⑧是氯,⑨是氩,⑩是钾,⑪是钙,⑫是溴,⑬是氢,⑭是氧元素,
(1)①是氮,氮的元素符号是:N;⑤是硅,元素符号是Si;⑦是硫,元素符号是S,故答案为:N;Si;S;
(2)④是Mg,Mg的原子序数是12,原子结构示意图为: ,⑥是Al,Al的原子序数是13,原子结构示意图为:
,⑥是Al,Al的原子序数是13,原子结构示意图为: ,⑧是Cl,Cl的原子序数是17,原子结构示意图为
,⑧是Cl,Cl的原子序数是17,原子结构示意图为 ,故答案为:
,故答案为: ;
; ;
; ;
;
(3)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar,故答案为:K;F;Ar;
(4)在这些元素中由于F为含氧酸,故高氯酸的酸性最强,化学式为:HClO4,由于K的金属性最强,故碱性最强的是KOH,铝的强氧化物呈现两性,故答案为:HClO4;KOH;Al(OH)3;
(5 )M为仅含非金属元素的盐,则M为铵盐,元素⑥的单质为Al,可推知N为氧化铝、Z为氢氧化铝,电解熔融的氧化铝得到Al,故X溶液与Y溶液是铝盐与氨水发生的反应,则:X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(6)③和④分别是Na和Mg,根据同主族元素金属性的递变规律可知,金属性Na>Mg,根据判断金属性强弱的方法,可依据二者单质分别与水反应的剧烈程度来判断其金属性强弱,即:与H2O反应,故答案为:Na;与水反应;
⑧⑫和分别是Cl和Br,根据同主族元素非金属性的递变规律可知,非金属性Cl>Br,根据判断非金属性强弱的方法,可依据二者气态氢化物的稳定性、单质之间的置换反应等来判断其非金属性强弱,即Cl2+2NaBr=2NaCl+Br2.故答案为:Cl2;Cl2+2NaBr=2NaCl+Br2.
点评 本题综合性较强,涵盖了元素周期表、元素性质的递变规律、元素金属性及非金属性强弱的判断方法等,要求用多方面的知识解决问题,能很好滴训练综合运用知识解决问题的能力.

| A. | 2Fe3++Fe═3Fe2+成立说明氧化性:Fe3+>Fe2+ | |
| B. | 25℃、pH=0的溶液中,Al3+、NH4+、NO3-、Fe2+可以大量共存 | |
| C. | 5.6 g铁与足量的氯气反应失去的电子为0.2 mol | |
| D. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O |
| A. | 足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+═Fe2++S↓+2H+ | |
| B. | 足量铁与稀硝酸反应:Fe+4H++NO3-═Fe2++4H2O+NO↑ | |
| C. | 醋酸溶液与纯碱反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | 异戊二烯(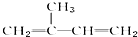 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 | |
| D. | 邻羟基苯甲酸与NaHCO3溶液反应 |
| A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 可用蘸浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 利用钠的性质制造的高压钠灯,可发出射程远、透雾能力强的黄光 |
| A. | 原子半径:Y<Z<W | |
| B. | 单质的还原性:Y>Z | |
| C. | 气态氢化物的稳定性:X<W | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
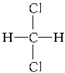 与
与 之间的关系是同种物质(填“同种物质”或“同分异构体”).
之间的关系是同种物质(填“同种物质”或“同分异构体”).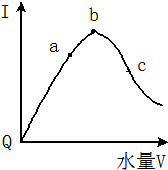 在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答:
在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答: