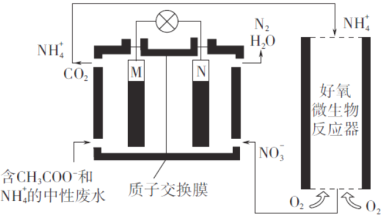
题目内容
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

(1)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是______________________________;滤渣可循环利用,滤渣的主要成分是____________(填化学式)。
(2)该工艺需控制NO和NO2物质的量之比接近1∶1。
若排放的尾气中NO含量升高,则NO和NO2物质的量之比______;若产品Ca(NO2)2中Ca(NO3)3含量升高,则NO和NO2物质的量之比_______。(填写序号)
①=1∶1 ②>1∶1 ③<1∶1 ④无法判断
(3)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,据此信息,某同学所写的反应离子方程式为2NO2-+2H+=NO2+NO↑+H2O,你同意吗?_________(填“同意”或“不同意“),如不同意,请说明你的理由________________________________________________。
【答案】使尾气中NO、NO2被充分吸收 Ca(OH)2 ② ③ 不同意 二氧化氮能与水会发生反应,产物中不可能生成二氧化氮
【解析】
由流程可知,石灰乳和硝酸工业的尾气(含NO、NO2)反应,生成Ca(NO2)2,过量的石灰乳以滤渣存在,碱性溶液中尾气处理较好;
(1)使尾气中NO、NO2与石灰乳充分接触;滤渣的主要成分是Ca(OH)2;
(2)若n(NO):n(NO2)>1:1,则一氧化氮过量,若<1:1,则二氧化氮过量;
(3)二氧化氮能与水会发生反应,据此分析解答。
由流程可知,石灰乳和硝酸工业的尾气(含NO、NO2)反应,生成Ca(NO2)2,过量的石灰乳以滤渣存在,
(1)使尾气中NO、NO2与石灰乳充分接触,NO、NO2被充分吸收,滤渣主要成分是Ca(OH)2;
(2)若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高,若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,产品中Ca(NO3)2含量升高;
(3)若离子方程式为2NO2-+2H+=NO2+NO↑+H2O,二氧化氮能与水会发生反应,产物中不可能生成二氧化氮,则不同意该同学书写的离子反应方程式。

【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
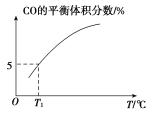
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。