题目内容
【题目】在2L的恒容容器中,充入1mol A和3mol B,并在一定条件下发生如下反应: A(s)+3B(g)2C(g)
若经3s后测得C的浓度为0.6molL﹣1 , 下列选项说法正确的组合是( )
①用A表示的反应速率为0.1molL﹣1s﹣1;
②用B表示的反应速率为0.4molL﹣1s﹣1;
③3s时生成C的物质的量为1.2mol;
④3s时B的浓度为0.6molL﹣1 .
A.①②④
B.①③④
C.③④
D.②③④
【答案】C
【解析】解:根据题意,B物质起始的浓度为1.5mol/L,经3s后测得C的物质的量浓度为0.6molL﹣1 , 则
A(s)+ | 3B(g) | 2C(g) | ||
开始(mol/L) | 1.5 | 0 | ||
转化(mol/L) | 0.9 | 0.6 | ||
3s时(mol/L) | 0.6 | 0.6 |
①反应中A为固体,不能用物质A表示反应的速率,故不选;
②根据上面的分析,B转化的浓度为0.9mol/L,所以用B表示的反应速率为 ![]() =0.3molL﹣1s﹣1 , 故不选;
=0.3molL﹣1s﹣1 , 故不选;
③3s时生成C的物质的量为0.6molL﹣1×2L=1.2mol,故选;
④根据上面的分析可知,3s时B的浓度为0.6molL﹣1 , 故选,
故选C.
根据题意,B物质起始的浓度为1.5mol/L,经3s后测得C的物质的量浓度为0.6molL﹣1 , 则
A(s)+ | 3B(g) | 2C(g) | ||
开始(mol/L) | 1.5 | 0 | ||
转化(mol/L) | 0.9 | 0.6 | ||
3s时(mol/L) | 0.6 | 0.6 |
以此计算转化率及反应速率,并结合平衡的移动及判定来解答;

【题目】无机化合物可根据其组成和性质进行分类:
(1)Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,将化学式分别填在表②的后面;(只需填一种)
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 | ③NaOH | ⑤Na2SO4 | ⑦SO2 | ⑨NH3 |
(2)写出⑦转化为⑧的化学方程式;
(3)写出Cu和①的浓溶液反应的化学方程式;
(4)实验室制备⑨常用和反应,检验该气体的方法是 .
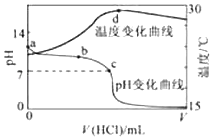
【题目】用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考图,从下表中选出正确选项( )
锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
A | 碱 | 酸 | 石蕊 | (乙) |
B | 酸 | 碱 | 酚酞 | (甲) |
C | 碱 | 酸 | 甲基橙 | (甲) |
D | 酸 | 碱 | 石蕊 | (乙) |
![]()
A.A
B.B
C.C
D.D