题目内容
【题目】室温下,将1.000molL﹣1盐酸滴入20.00mL 1.000molL﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( ) 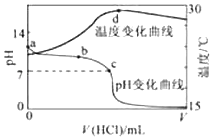
A.a点由水电离出的c(H+)=1.0×10﹣14mol/L
B.b点:c(NH4+)+c(NH3H2O)>c(Cl﹣)
C.b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL
D.d点后,溶液温度略下降的主要原因是NH3H2O电离吸热
【答案】B
【解析】解:A.因a点7<pH<14,因此水电离出的c(H+)>1.0×10﹣14molL﹣1 , 故A错误; B.盐酸和氨水反应,溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒可知c(Cl﹣)=c(NH4+),b点时pH>7,则氨水过量,c(NH4+)+c(NH3H2O)>c(Cl﹣),因同一溶液,溶液体积相同,所以n(NH4+)+n(NH3H2O)>n(Cl﹣),故B正确;
C.C点溶液呈中性,则c(H+)=c(OH﹣),氯化铵是强酸弱碱盐,其水溶液呈酸性,要使其水溶液呈中性,则氨水应该稍微过量,所以消耗盐酸的体积V<20 mL,b点时pH>7,则氨水过量更多,b点时加入的盐酸体积小于20.00mL,故C错误;
D.d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选B.
A.根据酸碱滴定过程的图中a点的pH值来分析溶液中离子的浓度;
B.b点时pH>7,盐酸和氨水反应,氨水过量,反应后溶质为氯化铵和氨水;
C.b点时加入的盐酸体积小于20.00mL,c点时加入的盐酸体积小于20.00mL;
D.根据d点盐酸和氨水恰好完全反应,放热最多分析.

练习册系列答案
相关题目