题目内容
【题目】按要求填空。
(1)利用铅蓄电池电解氯化钠溶液,其在充电时阳极反应为____,放电生成的固体会附聚在电极表面,工作过程中若正极质量增重96g时,理论上电路中转移的电子数为____。
(2)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为_______。
(3)某实验小组同学对电化学原理进行了一系列探究活动。
①如图1为某实验小组依据氧化还原反应:(用离子方程式表示)_____设计的原电池装置

②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图2所示。
在甲装置中铜电极反应为_______________;乙装置中石墨(1)为________极(填“正”、“负”、“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为_________________.
③某课题组利用图3所示装置,探究NO2和O2化合生成N2O5形成原电池的过程,该电池的正极反应式应为___________。
【答案】 PbSO4-2e-+2H2O =PbO2 +SO42-+4H+ 3NA CH3OH6e-+ H2O=CO2+6H+ Fe+Cu2+=Fe2++Cu O2+2H2O+4e-=4OH- 阴 2Cl--2e-=Cl2↑ O2+2N2O5+4e-=4NO3-
【解析】(1)铅蓄电池的正极反应为PbO2 +SO42-+4H+ + 2e-= PbSO4+2H2O,将其倒过来就是充电的阳极反应:PbSO4-2e-+2H2O =PbO2 +SO42-+4H+。正极反应为PbO2 +SO42-+4H+ + 2e-= PbSO4+2H2O,得到:每反应1molPbO2,转移2mol e-,得到1molPbSO4,即质量增加64g(1molPbSO4质量减去1mol PbO2的质量)。由上得到:每转移2mol e-正电极质量增加64g,现在质量增加96g,所以转移电子数为3NA。
(2)甲醇燃料电池,用稀硫酸作电解质溶液,总反应相当于是甲醇燃烧,即:CH3OH+3/2O2=CO2+2H2O,正极一定是氧气得电子:O2+4e-+ 4H+=2H2O,总反应减去正极反应(注意将正极扩大3/2倍,以除去氧气)得到负极反应CH3OH6e-+ H2O=CO2+6H+。
(3)①该原电池的总反应是单质铁(负极)与硫酸铜溶液(正极)的置换反应,即:Fe+Cu2+=Fe2++Cu。
②图2中,甲为原电池对乙的电解池进行电解。甲中铁为负极,铜为正极,总反应为铁的吸氧腐蚀。所以铜电极的反应为O2+2H2O+4e-=4OH-。石墨(1)连在原电池负极(铁)上,所以是电解的阴极。乙装置中与铜丝相连石墨电极为电解的阳极,阳极反应选择溶液中的氯离子失电子,所以为2Cl--2e-=Cl2↑。
③明显通氧气的为正极,正极反应为氧气得电子。因为电解质是熔融的硝酸钠,所以氧气得电子只能生成硝酸根离子(应该生成电解质中存在的离子)。根据图示,正极还要通入Y物质,而Y是负极的生成物,考虑到这个原电池的目的是:探究NO2和O2化合生成N2O5形成原电池的过程,所以Y只能是N2O5,所以正极一定是氧气和N2O5得电子生成硝酸根离子,即:O2+2N2O5+4e-=4NO3-。

【题目】相关物质的溶度积常数见下表(25℃):
物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
Ksp(单位略) | 1.1×10—11 | 2.3×10﹣3 | 1.8×10﹣10 | 1.9×10﹣12 |
下列有关说法中不正确的是
A. 浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B. 将0.001 molL﹣1的AgNO3溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1 的K2CrO4混合溶液中.先产生Ag2CrO4沉淀
C. 0.11 molL﹣1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D. 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
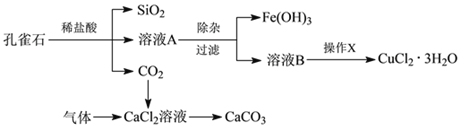
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
物质 | pH (开始沉淀) | pH(完全沉淀) |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.0 | 9.0 |
Cu(OH)2 | 4.7 | 6.7 |
(1)在除杂过程时为了除去Fe2+,常加入绿色氧化剂,使Fe2+氧化为Fe3+,此过程涉及的离子方程式为________。
(2)然后再加入适当物质调节溶液的pH至_________ (填写范围),使Fe3+转化为Fe(OH)3,可以达到除去Fe3+,调整溶液pH不可选用下列中的________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(3)检验Fe(OH)3是否沉淀完全的实验方案是________________________。
(4)操作X包括________、________、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 ______________。
(5)某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.6g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①读数时,若滴定前平视,滴定后仰视,则所测CaCO3的质量分数将________(选填“偏大”、“偏小”或“无影响”)。
②若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为_______。