题目内容
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,
写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。
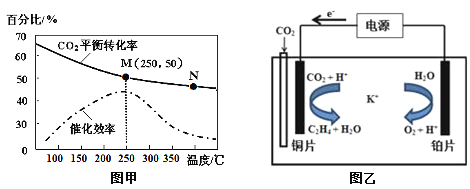
下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
【答案】(1)①0.4mol/L
②0.04mol/(L.min)
③增大压强(升高温度、使用催化剂等等合理均可)
(2)①6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol
CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol
②a
③7.7% 或0.077
(3)2CO2+12H++12e﹣== CH2=CH2+4H2O
【解析】
试题分析:(1) CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度mol/L:0.6 0.5 0
转化浓度mol/L: 0.2 0.4 0.2
平衡浓度mol/L: 0.4 0.1 0.2
① 10min后达到平衡时CO的浓度为0.4mol/L;②10min内用H2表示的平均反应速率为:v=![]() =
=![]() =0.04mol/(L.min);③若要加快CH3OH的生成速率,可采取的措施有:增大压强(升高温度、使用催化剂等等)
=0.04mol/(L.min);③若要加快CH3OH的生成速率,可采取的措施有:增大压强(升高温度、使用催化剂等等)
(2)①4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,2mol二氧化碳放出127.8 kJ 的热量,则热化学方程式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol; ②a.N点的温度高,但是,催化剂的效率低,速率不一定最大,错误;b.根据图象,温度在约250℃时,催化剂的催化效率最高,正确;c.根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动,乙烯的产量M点比N高,正确;故选a;
CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol; ②a.N点的温度高,但是,催化剂的效率低,速率不一定最大,错误;b.根据图象,温度在约250℃时,催化剂的催化效率最高,正确;c.根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动,乙烯的产量M点比N高,正确;故选a;
③设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%,所以有6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)
开始 3 1 0 0
转化 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
所以乙烯的体积分数为:0.25÷(1.5+0.5+0.25+1)×100%=7.7%;
(3)CO2在阴极上得电子生成乙烯,所以其电极反应方程式为:2CO2+12H++12e﹣== CH2=CH2+4H2O。