题目内容
【题目】硫单质及其化合物在工农业生产中有着吸要的应用.
(l)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJmol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJmol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H= _________;
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O.当生成H3AsO4的物质的量为0.6mol,反应中转移电子的数目为_________。
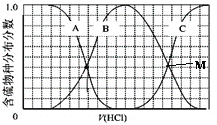
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出),滴加过程中,溶液中微位浓度大小关系正确的是_________ (填字母)。
A.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
B.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
C.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
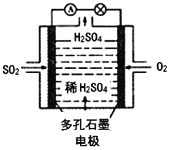
(4)某学习小组以SO2为原料,采用电化学方法制取硫酸。该小组设计的原电池原理如图2所示.写出该电池负极的电极反应式_________;
(5)难溶物ZnS遇CuSO4认溶液会慢慢转化为铜蓝(CuS)。若转化后溶液中c(Zn2+)=3.0×10-2molL-1,则c(Cu2+)= _________ molL-1〔已知Ksp(CuS)=1.0×10-36,Ksp(ZnS)=1.0×10-24
【答案】
(1)-41.8 kJmol-1.
(2)3mol;
(3)C;
(4)SO2-2e-+2H2O═SO42-+4H+;
(5)3.0×10-14;
【解析】
试题分析:(1)已知:①2SO2(g)+O2═2SO3(g)△H=-196.6kJmol-1,②2NO(g)+O2═2NO2(g)△H=-113.0kJmol-1,根据盖斯定律可知:将![]() ×①
×①![]() ×②,可得:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=
×②,可得:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=![]() KJ/mol
KJ/mol![]() KJ/mol=-41.8 kJmol-1故答案为:-41.8 kJmol-1.
KJ/mol=-41.8 kJmol-1故答案为:-41.8 kJmol-1.
(2)由反应可知,As元素的化合价由+3价升高为+5价,S元素的化合价由-2价升高为0,生成2molH3AsO4时,转移电子10mol,则生成H3AsO4的物质的量为0.6mol,反应中转移电子的数目为3mol,故答案为:3mol;
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度减小为S2-,B先增加后减少为HS-,C浓度一直在增加为H2S,向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],故选C;
(4)该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,故答案为:SO2-2e-+2H2O═SO42-+4H+;
(5)ZnS转化为CuS的离子方程式为:ZnS(s)+Cu2+(aq)![]() Zn2+(aq)+CuS(s);Ksp(ZnS)=c(Zn2+)c(S2-)=1.0×10-24,c(Zn2+)=3.0×10-2molL-1,则c(S2-)=
Zn2+(aq)+CuS(s);Ksp(ZnS)=c(Zn2+)c(S2-)=1.0×10-24,c(Zn2+)=3.0×10-2molL-1,则c(S2-)=![]() ×10-22,Ksp(CuS)=1.0×10-36,所以c(Cu2+)=
×10-22,Ksp(CuS)=1.0×10-36,所以c(Cu2+)=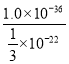 =3.0×10-14,故答案为:3.0×10-14。
=3.0×10-14,故答案为:3.0×10-14。