题目内容
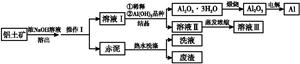
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq)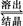 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。

已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq)
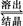 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3](1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
(1)过滤 Fe2O3
(2)将铝土矿粉碎、加热、搅拌、增大NaOH的浓度(任答三点即可)
(3)稀释降低了NaOH的浓度,有利于NaAlO2的水解,使平衡向结晶方向移动(或向左移动)
(4)CO2(过量)+Al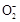 +2H2O
+2H2O Al(OH)3↓+HC
Al(OH)3↓+HC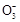 或2CO2(过量)+2Al
或2CO2(过量)+2Al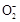 +4H2O
+4H2O Al2O3·3H2O↓+2HC
Al2O3·3H2O↓+2HC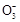
(5)将溶液Ⅲ循环使用溶解铝土矿
(2)将铝土矿粉碎、加热、搅拌、增大NaOH的浓度(任答三点即可)
(3)稀释降低了NaOH的浓度,有利于NaAlO2的水解,使平衡向结晶方向移动(或向左移动)
(4)CO2(过量)+Al
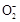 +2H2O
+2H2O Al(OH)3↓+HC
Al(OH)3↓+HC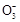 或2CO2(过量)+2Al
或2CO2(过量)+2Al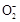 +4H2O
+4H2O Al2O3·3H2O↓+2HC
Al2O3·3H2O↓+2HC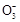
(5)将溶液Ⅲ循环使用溶解铝土矿
流程原理分析如下:铝土矿(Al2O3、SiO2、Fe2O3)经NaOH溶液处理,Al2O3、SiO2转化为NaAlO2、Na2SiO3,然后过滤,滤出的Fe2O3成为赤泥。对于NaAlO2、Na2SiO3的混合液,经稀释,NaOH浓度降低,使NaAlO2的水解平衡向结晶方向移动(或向左移动),从而得到Al(OH)3(Al2O3·3H2O),然后煅烧去水得到Al2O3,电解熔融Al2O3得到金属Al。在促使Al(OH)3(Al2O3·3H2O)析出的过程中也可以用通入CO2气体的方法,通过反应CO2(过量)+Al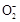 +2H2O
+2H2O Al(OH)3↓+HC
Al(OH)3↓+HC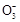 得到Al(OH)3。溶液Ⅱ主要是析出Al(OH)3后,残留有NaAlO2、Na2SiO3的NaOH溶液,经蒸发浓缩可以继续溶解铝土矿。
得到Al(OH)3。溶液Ⅱ主要是析出Al(OH)3后,残留有NaAlO2、Na2SiO3的NaOH溶液,经蒸发浓缩可以继续溶解铝土矿。
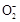 +2H2O
+2H2O Al(OH)3↓+HC
Al(OH)3↓+HC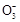 得到Al(OH)3。溶液Ⅱ主要是析出Al(OH)3后,残留有NaAlO2、Na2SiO3的NaOH溶液,经蒸发浓缩可以继续溶解铝土矿。
得到Al(OH)3。溶液Ⅱ主要是析出Al(OH)3后,残留有NaAlO2、Na2SiO3的NaOH溶液,经蒸发浓缩可以继续溶解铝土矿。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

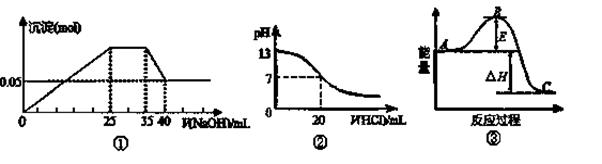
 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高
2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
 Fe2O3 + 2Al
Fe2O3 + 2Al