��Ŀ����
ij���Ͻ�(Ӳ��)�к���þ��ͭ���裬Ϊ�˲ⶨ�úϽ������ĺ����������������ʵ�飺
(1)ȡ��Ʒa g����ȡʱʹ�õ���������Ϊ ��
(2)����Ʒ��������ϡ�����У����ˣ���Һ����Ҫ���� �������к��� �����ܽ����ʱʹ�õ���Ҫ���������� ��
(3)����Һ�м������NaOH��Һ�����ˣ�д���ò��������йصĻ�ѧ����ʽ ��
(4)�ڵ�(3)������Һ��ͨ������CO2�����ˣ�������������ˮϴ�����κ�ɲ��������������ټ���Ϊֹ����ȴ�����������Ϊb g���йط�Ӧ�Ļ�ѧ����ʽΪ ��
(5)����Ʒ���������������ı���ʽΪ ��
(1)ȡ��Ʒa g����ȡʱʹ�õ���������Ϊ ��
(2)����Ʒ��������ϡ�����У����ˣ���Һ����Ҫ���� �������к��� �����ܽ����ʱʹ�õ���Ҫ���������� ��
(3)����Һ�м������NaOH��Һ�����ˣ�д���ò��������йصĻ�ѧ����ʽ ��
(4)�ڵ�(3)������Һ��ͨ������CO2�����ˣ�������������ˮϴ�����κ�ɲ��������������ټ���Ϊֹ����ȴ�����������Ϊb g���йط�Ӧ�Ļ�ѧ����ʽΪ ��
(5)����Ʒ���������������ı���ʽΪ ��
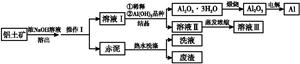
(1)������ƽ
(2)MgCl2��AlCl3��Cu��Si��©�����ձ���������
(3)MgCl2��2NaOH=Mg(OH)2����2NaCl�� AlCl3��3NaOH=Al(OH)3����3NaCl�� Al(OH)3��NaOH=NaAlO2��2H2O
(4)NaAlO2��CO2��2H2O=NaHCO3��Al(OH)3�� 2Al(OH)3 Al2O3��3H2O
Al2O3��3H2O
(5)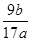 ��100%
��100%
(2)MgCl2��AlCl3��Cu��Si��©�����ձ���������
(3)MgCl2��2NaOH=Mg(OH)2����2NaCl�� AlCl3��3NaOH=Al(OH)3����3NaCl�� Al(OH)3��NaOH=NaAlO2��2H2O
(4)NaAlO2��CO2��2H2O=NaHCO3��Al(OH)3�� 2Al(OH)3
 Al2O3��3H2O
Al2O3��3H2O(5)
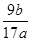 ��100%
��100%�����ܽ�Ӳ��ʱ��ͭ�����Ϊ��������Һ�ɷ�ΪMgCl2��AlCl3����Һ�м�������NaOH���ˣ�����ΪMg(OH)2����Һ��������Ҫ��NaAlO2����Һ��ͨ������CO2������Al(OH)3��Al(OH)3������ճ�ΪAl2O3���ɹ�ϵʽ��2Al��Al2O3
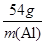 ��
��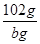 ��m(Al)��
��m(Al)��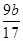 g
g
Al������������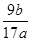 ��100%
��100%
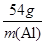 ��
��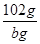 ��m(Al)��
��m(Al)��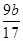 g
gAl������������
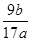 ��100%
��100%
��ϰ��ϵ�д�
 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д� ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д�
�����Ŀ
 2K2SO4+2Al2O3 +9SO2 +48H2O�������ж���ȷ����
2K2SO4+2Al2O3 +9SO2 +48H2O�������ж���ȷ����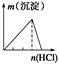

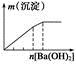

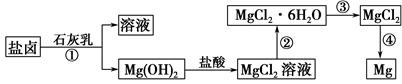
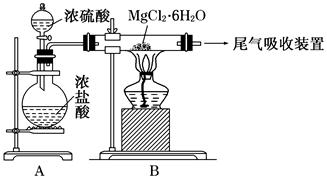

 2NaAlO2(aq)+4H2O,[Al2O3��3H2OҲ�ɱ�ʾΪ2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3��3H2OҲ�ɱ�ʾΪ2Al(OH)3]