题目内容
下列各表述与示意图图中一致的是 ( )


| A.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH 随加入酸体积的变化 |
| B.图①中使用的NaOH的浓度一定为2 mol/L |
| C.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+)∶n(Al3+):n( NH4+)=2∶3∶2 |
D.图③中曲线表示3H2(g)+N2(g) 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 |
A
试题分析:A.在反应开始时,c(NaOH)=0.1mol/L,c(H+)=10-13mol/L,pH=13,随着酸的不断滴入,溶液的碱性逐渐减弱pH逐渐减小,当滴入20 mL 0.1 mol·L-1 HCl溶液时,二者恰好完全反应。溶液为中性,pH=7.盐酸不断滴入,这时溶液就由中性变为酸性,酸性逐渐增强,所以pH越来越小。正确。B.因为金属离子的种类、浓度不定,所以NaOH的浓度也无法确定。错误。C.使Al3+转化为Al(OH)3沉淀消耗的OH-的物质的量与使Al(OH)3沉淀溶解消耗的OH-的物质的量的比为3:1.假设5mld NaOH溶液中含有1mol的NaOH.,则含Al3+1mol,沉淀Al3+的NaOH的物质的量为3mol,(15ml).沉淀Mg2+的NaOH为10ml,所以n(Mg2+)=2mol.因为发生反应:NH4++OH-=NH3·H2O。铵根离子消耗的NaOH为10ml,所以n(NH4+)= 2mol..因此三种离子的物质的量之比为:n(Mg2+)∶n(Al3+):n( NH4+)=2∶1∶2。错误。D.催化剂能改变反应途径,降低反应的活化能,但是不能改变反应热。所以若使用催化剂,B点会降低。错误。

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目


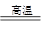 3Mg+Al2O3
3Mg+Al2O3
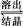 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]