题目内容
11.某钠盐溶液中通入足量氨气,无明显现象.再在所得溶液中通入过量CO2,产生大量白色沉淀.(1)写出氨气的电子式
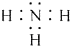 .
.(2)该钠盐溶液中一定不可能含有下列哪种微粒B(填编号).
A.Cl- B.Fe2+ C.SiO32- D.AlO2-
(3)写出一个通入过量CO2时生成白色沉淀的离子方程式CO2+A1O2-+2H2O=Al(OH)3↓+HCO3-.
分析 (1)氨气为共价化合物,氮原子与氢原子通过共用电子对结合;
(2)钠盐溶液中通入足量氨气,无明显现象,再在所得溶液中通入过量CO2,产生大量白色沉淀,不可能含有Fe2+,因通入氨气会产生白色沉淀,迅速变化灰绿色,最终变为红褐色;可能为硅酸钠、偏铝酸钠,可能为NaCl;
(3)溶液若是偏铝酸钠溶液,通入二氧化碳反应生成碳酸氢钠和氢氧化铝沉淀.
解答 解:(1)氨气为共价化合物,氮原子与氢原子通过共用电子对结合,电子式为: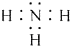 ,故答案为:
,故答案为: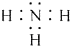 ;
;
(2)钠盐溶液中通入足量氨气,无明显现象,再在所得溶液中通入过量CO2,产生大量白色沉淀,不可能可以Fe2+,因通入氨气会产生白色沉淀,迅速变化灰绿色,最终变为红褐色;可能为硅酸钠、偏铝酸钠,可能为NaCl,可能含有Cl-、SiO32-、AlO2-,
故选:B;
(3)溶液若是偏铝酸钠溶液,通入二氧化碳反应生成碳酸氢钠和氢氧化铝沉淀,离子方程式:CO2+A1O2 -+2H2O=Al(OH)3↓+HCO3-,故答案为:CO2+A1O2 -+2H2O=Al(OH)3↓+HCO3-.
点评 本题考查了电子式的书写、离子的检验、离子方程式书写,明确掌握基础是解题关键,题目难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
1.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 加入甲基橙试液呈红色的溶液 NH4+,K+,SO42-,Cl- | |
| B. | 饱和氯水中 Cl-、NO3-、Na+、SO32- | |
| C. | Na2S溶液中 SO42-、K+、Cl-、Cu2+ | |
| D. | pH=12的溶液中 NO3-、I-、Na+、Al3+ |
2.下列现象或事实可用同一化学原理加以说明的是( )
| A. | 氯化铵和碘都可以用加热法进行提纯 | |
| B. | 铜和氯化钠溶液均能导电 | |
| C. | 硫酸亚铁溶液和氢氧化钠溶液在空气中留置均会变质 | |
| D. | 铁片和铝片置于冷的浓硫酸中均无明显现象 |
19.岩白菜素具有镇痛、镇静及安定作用等作用,其结构简式如图,下列说法正确的是( )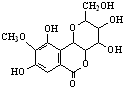

| A. | 能与FeCl3溶液发生显色反应 | |
| B. | 该分子中含有3个手性碳原子 | |
| C. | 该化合物可与Br2发生取代反应 | |
| D. | 1mol该化合物最多可与5molNaOH反应 |
6.某反应进行过程中,各物质物质的量的变化情况如图所示.下列说法正确的是( )


| A. | C、D是生成物 | B. | 反应的方程式为:2A+B═2C | ||
| C. | 2min后各物质的量不再变化 | D. | 该反应不是可逆反应 |
16.下列物质中,既有离子键,又有极性键的是( )
| A. | HCl | B. | KOH | C. | CaCl2 | D. | CH4 |