��Ŀ����
����Ŀ����ҵ�������̿�(��Ҫ�ɷ�ΪMnO2) Ϊ��Ҫԭ���Ʊ��������(KMnO4)�Ĺ����������£�
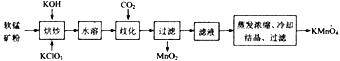
�ش��������⣺
(1)ԭ�����̿���ʹ��֮ǰͨ������飬��Ŀ����_________________________________��
(2)���泴��ʱ�ǽ���������ij�ֲ��ʵ������ڣ���Ͼ��ȣ�С����������ڣ���K2MnO4��KCl���ɣ���泴�����з�����Ӧ�Ļ�ѧ����ʽΪ________________�����泴��ʱ���������IJ��ʿ���ѡ��_______(����ĸ)��
a��ʯӢ b�������� c���������մ� d����
(3)��֪ˮ�ܹ�������ѧ��Ӧ������ͨ��CO2ʹ��Ӧ��ϵ�����Ի������Լ��ɷ����绯��Ӧ�����绯ʱ������Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ_______________��
(4)����Һ��������Ũ��ʱ���¶Ȳ��˳���60��,��ԭ����_________________���������¶ȿ�����60�����ҵ���Ѳ���������_______________________��
(5)�����п���ѭ�����õ�������___________________��
(6)��CO2�绯����K2MnO4ת��ΪKMnO4���ڴ�ͳ���գ��ִ����ն���õ�ⷨ�������K2MnO4ˮ��Һ�����������������ĵ缫��ӦΪ_________________���롰CO2�绯������ȣ�����ⷨ���������ŵ���____________________��
���𰸡� ����Ӧ��ĽӴ��棬�ӿ컯ѧ��Ӧ���ʣ����ԭ�ϵ������� 3MnO2 + 6KOH + KClO3 ![]() 3K2MnO4 + KCl + 3H2O d 2��1 ��ֹ�¶ȹ��ߵ���KMnO4�ֽ� ˮԡ���� MnO2 MnO42-��e- = MnO4- KMnO4�Ĵ��ȸߡ����ʸ�
3K2MnO4 + KCl + 3H2O d 2��1 ��ֹ�¶ȹ��ߵ���KMnO4�ֽ� ˮԡ���� MnO2 MnO42-��e- = MnO4- KMnO4�Ĵ��ȸߡ����ʸ�
����������1����ҵ�����н�ԭ�Ϸ����Ŀ��һ����Ϊ������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�ͬʱ�����������ԭ��ת��Ϊ��������ԭ�ϵ������ʡ�
��2�����泴��ʱ��MnO2��KClO3��KOHת��ΪK2MnO4��KCl������ʽΪ��3MnO2 + 6KOH + KClO3 ![]() 3K2MnO4 + KCl + 3H2O����Ϊ�����м�������������������ǿ���������ǿ�Ӧ�����ʶ�����ʹ�ã����磬ʯӢ���������裩�����������մɣ����к��ж������裩������ֻ��ʹ����������ѡ��d��ȷ��
3K2MnO4 + KCl + 3H2O����Ϊ�����м�������������������ǿ���������ǿ�Ӧ�����ʶ�����ʹ�ã����磬ʯӢ���������裩�����������մɣ����к��ж������裩������ֻ��ʹ����������ѡ��d��ȷ��
��3������Һ��ͨ�������̼ʱ��Ӧ����K2MnO4�����绯�����е�Mn�Ļ��ϼ�һ��������һ���ֽ��ͣ��õ�KMnO4��MnO2������ʽΪ3K2MnO4 + 4CO2 + 2H2O = 2KMnO4 + MnO2�� + 4KHCO3����������������KMnO4���뻹ԭ���MnO2�������ʵ���֮��Ϊ2:1��
��4����������ڽϸ��¶Ȼᷢ���ֽⷴӦ����������Ũ����ʱ���¶Ȳ��˹��ߡ������¶�Ϊ60�棬����ˮ�ķе㣬���ԱȽϺ��ʵķ�����ˮԡ���ȡ�
��5���ڹ�����һ���õ���MnO2���Լ��뵽��һ���ĺ泴��������MnO2����ѭ����
��6�����ʱ����K2MnO4ת��ΪKMnO4������Mn�Ļ��ϼ����ߣ�����������ʧ���ӻ��ϼ����ߵķ�Ӧ���ǣ�MnO42-��e- = MnO4-������CO2�绯������ȣ�����ⷨ���������ŵ��ǽ����е���Ԫ�ض�ת��Ϊ�������������˸�����صIJ�����ͬʱ�õ���������Ĵ�����Ҳ�ϸ���

 ֥�鿪���γ�������ϵ�д�
֥�鿪���γ�������ϵ�д� ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�����Ŀ������������ֳ�Ī���Σ���dz��ɫ���壮���ڿ����б�һ���������ȶ����dz��õ�Fe2+�Լ���ijʵ��С�����ù�ҵ����м��ȡĪ���Σ����ⶨ�䴿�ȣ�
��֪����
| 10 | 20 | 30 | 40 | 50 | 70 |
��NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO47H2O | 40.0 | 48.0 | 60.0 | 73.3 | �� | �� |
��NH4��2SO4FeSO46H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
��Ī�������Ҵ��ܼ������ܣ�
����Ī���ε���ȡ

�Է�����
��1����������м����ʣ��ʱ���й��ˣ���ԭ����______________________��
��2������3�а�����ʵ���������_____________________��
��3����ƷĪ���������______________________ ϴ�ӣ�����ĸ��ţ���
a������ˮ b���Ҵ� c����Һ
��Ϊ�ⶨ��������泥�NH4��2SO4FeSO46H2O���崿�ȣ�ijѧ��ȡm g�����������Ʒ���Ƴ�500mL��Һ������������ɼס��ҡ�����λͬѧ�������������ʵ�鷽������ش�
����һ��ȡ20.00mL�����������Һ��0.1000molL��1������KMnO4��Һ�����ν��еζ���
��������ȡ20.00mL�����������Һ��������ʵ�飮
![]()
��4����ʵ���������ȷ��������һ�IJⶨ�������С�ڷ������������ԭ��Ϊ_________����֤�Ʋ�ķ���Ϊ��___________________________________________����������ͨ��NH4+�ⶨ��ʵ�����ͼ������ʾ��ȡ20.00mL�����������Һ���и�ʵ�飮

��5��װ��___________ ����ס����ҡ�����Ϊ�������ж�������_______________��
��6��������������Լ���__________ ������ĸ��ţ���ѡ���ҡ�����˿գ���ѡ���ס��˿տɲ����
a��ˮ b������NaHCO3��Һ c��CCl4
��7�������NH3�����ΪV L��������Ϊ��״���£��������������茶���Ĵ���Ϊ_______��

