题目内容
【题目】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
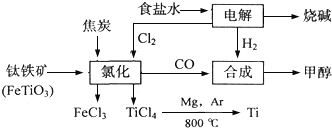
(1)写出电解食盐水反应的离子方程式________________________________。阳极上每生成标准状况下的11.2L气体,转移电子的物质的量是_______
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
(3)反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是__________.
2MgCl4+Ti在Ar气氛中进行的理由是__________.
(4)在上述产业链中,合成192t甲醇理论上需额外补充H2_______t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是___________________________.
【答案】 2Cl﹣+2H2O![]() 2OH﹣+H2↑+Cl2↑ 1mol 2FeTiO3+6C+7Cl2
2OH﹣+H2↑+Cl2↑ 1mol 2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化 10 2CH3OH﹣12e﹣+16OH﹣=2CO32﹣+12H2O
2FeCl3+2TiCl4+6CO Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化 10 2CH3OH﹣12e﹣+16OH﹣=2CO32﹣+12H2O
【解析】(1)电解食盐水反应的离子方程式为:2Cl﹣+2H2O![]() 2OH﹣+H2↑+Cl2↑;氯离子在阳极上失去电子生成氯气,标准状况下的11.2L的氯气的物质的量为0.5mol,转移电子的物质的量为1mol。(2)在氯化过程中,FeTiO3与C、Cl2反应生成FeCl3、CO、TiCl4,化学方程式为:2FeTiO3+6C+7Cl2
2OH﹣+H2↑+Cl2↑;氯离子在阳极上失去电子生成氯气,标准状况下的11.2L的氯气的物质的量为0.5mol,转移电子的物质的量为1mol。(2)在氯化过程中,FeTiO3与C、Cl2反应生成FeCl3、CO、TiCl4,化学方程式为:2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO;(3)Mg和Ti都有强还原性,在高温条件易空气中氧气被氧化,而在Ar气氛中可以防止被氧化。(4)因2H2+CO——CH3OH,2Cl﹣+2H2O
2FeCl3+2TiCl4+6CO;(3)Mg和Ti都有强还原性,在高温条件易空气中氧气被氧化,而在Ar气氛中可以防止被氧化。(4)因2H2+CO——CH3OH,2Cl﹣+2H2O![]() 2OH﹣+H2↑+Cl2↑,2FeTiO3+6C+7Cl2
2OH﹣+H2↑+Cl2↑,2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO;192t甲醇的物质的量为6×106mol,需要氢气为12×106mol,需要一氧化为6×106mol,而生成6×106mol一氧化碳消耗氯气的物质的量为7×106mol,需要补充的氢气的物质的量为5×106mol,即10t。
2FeCl3+2TiCl4+6CO;192t甲醇的物质的量为6×106mol,需要氢气为12×106mol,需要一氧化为6×106mol,而生成6×106mol一氧化碳消耗氯气的物质的量为7×106mol,需要补充的氢气的物质的量为5×106mol,即10t。
(5)甲醇在负极失去电子被氧化为二氧化碳,生成的二氧化碳与氢氧化钾溶液反应生成碳酸钾,则负极上的电极反应式为:2CH3OH﹣12e﹣+16OH﹣=2CO32﹣+12H2O。
点晴:书写电化学半反应的技巧是由方程式画出双线桥,表示得、失电子转移关系,找出还原剂及被氧化后的产物,这里特别要注意被氧化后产物与介质是否反应,若反应,则两步合并书写,然后由电子守恒、电荷守恒、质量守恒配平即可。当然也可由总反应减去正极反应式就是负极反应式。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案【题目】对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数
酸 | 电离平衡常数K |
CH3COOH | 1.76×10﹣5 |
H2CO3 | K1=4.3×10﹣7 K2=5.61×10﹣11 |
H3PO4 | K1=7.52×10﹣3 K2=6.23×10﹣8 K3=2.20×10﹣13 |
回答下列问题:
(1)从电离的角度,HCO ![]() 、HPO
、HPO ![]() 、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
(2)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的CH3COOH的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH= .