题目内容
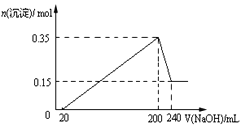
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合的溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B. pH=7的溶液中:c(Na+)= 2c(C2O42–)
C. c(HC2O4–)= c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+ c(HC2O4–)
D. c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
【答案】D
【解析】A、由图可以看出,pH=2.5时,c(H2C2O4)<0.02mol/L,c(C2O42-)<0.02mol/L,c(HC2O4-)>0.08mol/L,则c(H2C2O4)+ c(C2O42-)< c(HC2O4-),A项错误;B、根据电荷守恒得c(Na+)+ c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),pH=7.0时,c(H+)= c(OH-),则c(Na+)= c(HC2O4-)+2c(C2O42-),即c(Na+)>2c(C2O42-),B项错误;C、根据c(Na+)+ c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)且c(HC2O4-)+c(C2O42-)+ c(H2C2O4)=0.100mol/L,结合c(HC2O4-)= c(C2O42-)可得c(Na+)=0.100mol/L-c(HC2O4-)+c(H2C2O4)+c(OH-)-c(H+),由图可知c(HC2O4-)=c(C2O42-)时,溶液pH<7显酸性,则c(Na+)<0.100mol/L +c(HC2O4-), C项错误;D、c(Na+)=0.100mol/L时,则有c(Na+) =c(HC2O4-)+c(C2O42-)+ c(H2C2O4),溶液中根据电荷守恒可得c(Na+)+ c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),二式结合可得c(H+)+c(H2C2O4)= c(C2O42-)+c(OH-),D项正确;答案选D。

【题目】(1)已知甲、乙两物质分别由H、C、Na、O、Cl、Fe元素中的一种或几种组成,请按要求填空:
①若甲物质为碱性氧化物,则甲的化学式为___________________(写一种)。
②若乙物质可用于呼吸面具中作为氧气来源,则乙是___________,其供氧原理是__________(用化学方程式表示)。
(2)在横线上填入合适的符号:________+2H+=CO2↑+H2O+Ba2+
(3)写出氯气与水反应的化学方程式,并用双线桥法标出电于转移的方向和数目:______________________________________________________。
(4)选择合适的试剂除去下列括号内的杂质。(填化学式)
物质 | 选择的试剂 |
①FeCl2(FeCl3) | ______ |
②NO气体(NO2) | _____________ |