题目内容
17.已知下列反应的能量变化示意图如下,有关说法正确的是( )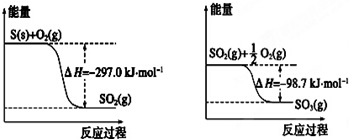
| A. | 1 mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量小于297.0 kJ | |
| B. | 在相同条件下,SO2 (g)比SO3 (g)稳定 | |
| C. | S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+$\frac{3}{2}$O2(g)?SO3(g)△H=+395.7 kJ•mol-1 | |
| D. | 一定条件下1 mol SO2(g)和$\frac{1}{2}$ mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ |
分析 A、相同量的 S(g)的能量大于S(s)的能量;
B、能量越高越不稳定;
C、依据图象根据盖斯定律分析计算,该反应为放热反应;
D、相同量的 SO3(g)的能量大于SO3(l)的能量;
解答 解:A、相同量的 S(g)的能量大于S(s)的能量,所以1mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量>297.0kJ/mol,故A错误;
B、能量越高越不稳定,由图象可知SO2(g)的能量大于SO3(g),所以SO3(g)比SO2(g)稳定,故B错误;
C、已知 S(s)+O2(g)=SO2(g)△H=-297.07kJ/mol,SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-98.7kJ/mol,把两个方程相加得到 S(s)+$\frac{3}{2}$O2(g)?SO3(g)△H=-395.7kJ/mol,故C错误;
D、依据图象分析可知反应放热,所以1mol SO2(g)和$\frac{1}{2}$mol O2(g)生成1mol SO3(g)放出98.7kJ/mol,又相同量的 SO3(g)的能量大于SO3(l)的能量,所以生成1 mol SO3(l)放出热量大于98.7 kJ,故D正确;
故选D.
点评 本题考查了化学反应能量变化的分析判断,图象分析是解题关键,题目较简单,注意盖斯定律的应用.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
7.能使酸性KMnO4溶液褪色的物质是( )
| A. | 醋酸 | B. | 聚乙烯 | C. | 乙醇 | D. | 苯 |
8.下列从混合物中分离出其中的某一成分,所采取的分离方法正确的是( )
| A. | 利用氯化钾与碳酸钙的溶解性差异,可用溶解、过滤的方法除去碳酸钙 | |
| B. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 | |
| C. | 水的沸点是100℃,酒精的沸点是78.5℃,所以可用加热蒸发法使含水酒精变为无水酒精 | |
| D. | 氯化钠的溶解度随温度的下降而减小,所以可用冷却法从热的含有少量氯化钾的氯化钠浓溶液中得到纯净的氯化钠晶体 |
5.铁和铁合金是生活中常用的材料,下列说法正确的是( )
| A. | 不锈钢是铁合金,只含金属元素 | |
| B. | 生铁的含碳量比钢高 | |
| C. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| D. | 铁合金的熔点低于纯铁的熔点 |
12.剧毒物质二噁英的结构为 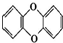 ,已知它的一氯代物有2种,则其七氯代物有( )
,已知它的一氯代物有2种,则其七氯代物有( )
 ,已知它的一氯代物有2种,则其七氯代物有( )
,已知它的一氯代物有2种,则其七氯代物有( )| A. | 8种 | B. | 10种 | C. | 2种 | D. | 12种 |
2.下列说法正确的是( )
| A. | 电池充电时其正极应与外电源的负极相连而成为阴极 | |
| B. | 氢氧燃料电池(碱性介质)的正极反应式:O2+4e-→2O2- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜 | |
| D. | 铁件上镀铜时,将铁件与电源的负极相连 |
6.实验室需用90mL0.1mol/L的硫酸铜溶液,用100mL的容量瓶配制,以下配制操作正确的是( )
| A. | 称取1.44g硫酸铜,配成100mL溶液 | B. | 称取2.25g胆矾,加入100mL水 | ||
| C. | 称取1.6g硫酸,加入100mL水 | D. | 称取2.5g胆矾,配成100mL溶液 |
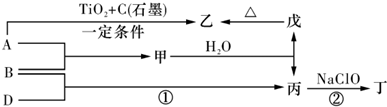
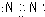 ,丁分子的结构式为H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙属于极性分子(填“极性”或“非极性”)
,丁分子的结构式为H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙属于极性分子(填“极性”或“非极性”)