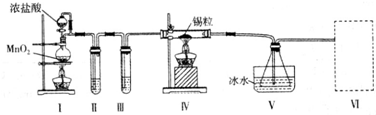
题目内容
9.(1)常温常压下,等质量的NO2和N2O4,二者的物质的量之比为2:1,原子个数之比为1:1,密度之比为1:2.(2)CO2气体在标准状况下的密度为1.96g/L.
(3)氢气是一种清洁的可再生能源.某氢氧燃料电池(氢气和氧气反应生成水)轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气的物质的量约为250mol.
分析 (1)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的构成计算,同温同压下,气体的密度之比等于摩尔质量之比;
(2)根据ρ=$\frac{M}{{V}_{m}}$计算;
(3)根据n=$\frac{m}{M}$计算氢气的物质的量,进而可计算氧气的物质的量.
解答 解:(1)NO2和N2O4的最简式相同,都为“NO2”,则等质量的NO2和N2O4,二者的物质的量之比为2:1,原子个数之比为1:1,同温同压下,气体的密度之比等于摩尔质量之比,密度之比为1:2,
故答案为:2:1;1:1;1:2;
(2)ρ=$\frac{M}{{V}_{m}}$=$\frac{44g/mol}{22.4L/mol}$=1.96g/L,故答案为:1.96;
(3)n(H2)=$\frac{1000g}{2g/mol}$=500mol,则需要氧气的物质的量为氢气的一半,为250mol,
故答案为:250mol.
点评 本题考查物质的量的计算,把握质量、微粒数、体积、物质的量的关系及分子的构成为解答的关键,注意相关计算公式的运用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列说法正确的是( )
| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 蜂、蚁蛰咬处涂抹稀氨水可止痒解痛未涉及化学变化 | |
| D. | 变质的油脂有难闻的气味,是由于油脂发生了氧化反应 |
17.已知下列反应的能量变化示意图如下,有关说法正确的是( )
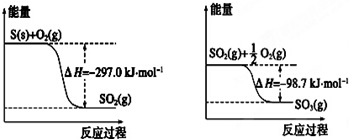

| A. | 1 mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量小于297.0 kJ | |
| B. | 在相同条件下,SO2 (g)比SO3 (g)稳定 | |
| C. | S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+$\frac{3}{2}$O2(g)?SO3(g)△H=+395.7 kJ•mol-1 | |
| D. | 一定条件下1 mol SO2(g)和$\frac{1}{2}$ mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ |
14.下列电离方程式,不正确的是( )
| A. | NaOH═Na++OH- | B. | H2SO4═H2++SO42- | C. | KClO3═ClO3-+K+ | D. | NaCl═Na++Cl- |
1.下列有关化学与生活、生产的叙述错误的是( )
| A. | 用作“钡餐”的物质主要成分是硫酸钡 | |
| B. | 采用催化设施,将汽车尾气中CO和NO转化为无害气体 | |
| C. | SO2具有还原性,可用于漂白纸浆 | |
| D. | 常温下,可以用铁制容器来盛装冷的浓硫酸 |
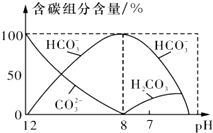 (1)一定温度下,向1L 0.l mol•L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中$\frac{c(C{H}_{3}CO{O}^{-}).c(H{+}^)}{c(C{H}_{3}COOH)}$不变(填“增大”、“减小”或“不变”).
(1)一定温度下,向1L 0.l mol•L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中$\frac{c(C{H}_{3}CO{O}^{-}).c(H{+}^)}{c(C{H}_{3}COOH)}$不变(填“增大”、“减小”或“不变”).