题目内容
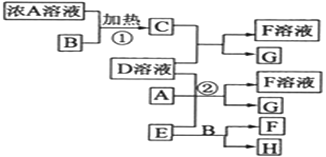
【题目】有关物质存在如图所示的转化关系(部分产物已省略)。通常C为黄绿色气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取可助燃的气体单质H。请回答下列问题:
(1)分离G的水溶液中G的方法____________________________________________;
(2)反应①的化学方程式为_________;从该反应中获得干燥纯净的C气体的方法是______;
(3)反应②的离子方程式为_______________________________________________;
(4)写出另外一种实验室制取H的化学方程式_______________________________。
(5)C的水溶液可使有色布条褪色,写出其原因(用离子反应方程式表示)_____;
(6)C的水溶液具有漂白性,SO2也具有漂白性,二者混合_______(填“能、否)增加漂白效果,写出其原因(用化学方程式表示)_______________________________。
【答案】萃取、分液、蒸馏MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O先通入饱和食盐水,然后通入浓硫酸6I-+ClO3-+6H+=3I2+Cl-+3H2O2H2O2
MnCl2+Cl2↑+2H2O先通入饱和食盐水,然后通入浓硫酸6I-+ClO3-+6H+=3I2+Cl-+3H2O2H2O2 ![]() 2H2O+O2↑或2KMnO4
2H2O+O2↑或2KMnO4![]() K2MnO4+MnO2+O2↑Cl2+H2O=Cl-+H++HClO否SO2+Cl2+2H2O=H2SO4+2HCl
K2MnO4+MnO2+O2↑Cl2+H2O=Cl-+H++HClO否SO2+Cl2+2H2O=H2SO4+2HCl
【解析】
C为黄绿色气体单质,C为氯气,G为紫黑色固体单质,G为碘。实验室中,常用固体E在B的催化下加热制取可助燃的气体单质H,则可推断知E为氯酸钾,B为二氧化锰,H为氧气;A的浓溶液与B加热生成C,则A为盐酸,C和D溶液反应生成F溶液和G,则D为碘化钾,F为氯化钾,据此解答。
(1)分离碘水中碘,可以通过有机溶剂萃取后分液,再通过蒸馏的方法分离碘和有机溶剂,故答案为:萃取、分液、蒸馏;
(2)反应①为实验室制氯气的反应,反应的化学方程式为4HCl(浓)+MnO2 ![]() MnCl2 +Cl2↑+2H2O,制得的氯气中混有氯化氢和水蒸气,可以先通入饱和食盐水,除去氯化氢,然后通入浓硫酸干燥,故答案为:4HCl(浓)+MnO2
MnCl2 +Cl2↑+2H2O,制得的氯气中混有氯化氢和水蒸气,可以先通入饱和食盐水,除去氯化氢,然后通入浓硫酸干燥,故答案为:4HCl(浓)+MnO2![]() MnCl2 +Cl2↑+2H2O;先通入饱和食盐水,然后通入浓硫酸;
MnCl2 +Cl2↑+2H2O;先通入饱和食盐水,然后通入浓硫酸;
(3)反应②为氯酸钾在酸性条件下氧化碘化钾,反应的离子方程式为6I-+ClO3-+6H+=3I2+Cl-+3H2O,故答案为:6I-+ClO3-+6H+=3I2+Cl-+3H2O;
(4)实验室可以用双氧水分解制氧气,反应的化学方程式为2H2O2![]() 2H2O+O2↑,还可以加热高锰酸钾分解制备,2KMnO4
2H2O+O2↑,还可以加热高锰酸钾分解制备,2KMnO4![]() K2MnO4+MnO2+O2↑,故答案为:2H2O2
K2MnO4+MnO2+O2↑,故答案为:2H2O2![]() 2H2O+O2↑或2KMnO4
2H2O+O2↑或2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(5)氯气的水溶液可使有色布条褪色,是因为反应生成的次氯酸具有漂白性,Cl2+H2O=Cl-+H++HClO,故答案为:Cl2+H2O=Cl-+H++HClO;
(6)把氯气与SO2按等物质的量一起通入品红溶液中,因为氯气与二氧化硫发生氧化还原反应,SO2+Cl2+2H2O=2HCl+H2SO4,失去了漂白作用,所以品红溶液不褪色,故答案为:否;SO2+Cl2+2H2O=2HCl+H2SO4。

 口算能手系列答案
口算能手系列答案【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
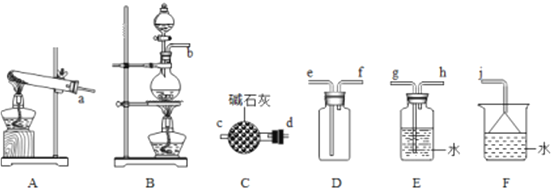
(1)氨气的制备
①用A装置可制备哪些常见气体_________,工业上制取氨气的化学方程式为____________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,向硬质玻璃管Y中加入少量催化剂并充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量无色液珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |