题目内容
【题目】【化学-选修3:物质结构与性质】(15分)
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是_________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)![]() Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式_______;两者相比较沸点较高的为_____(填化学式)。CN-中碳原子杂化轨道类型为_______,C、N、O三元素的第一电离能最大的为____(用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示。
①基态铜原子的核外电子排布式为___________。
②每个铜原子周围距离最近的铜原子数目________。

(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为___________pm(只写计算式)。
【答案】(1)第四周期第Ⅷ族(2分);(2)分子晶体;5;金属键;(各1分)
(3)N≡N;CO;sp杂化;N(各1分)(4)①[Ar]3d104s1;②12(各1分);
(5)①CuCl(1分);②共价(1分);③ (2分)
(2分)
【解析】
试题分析:(1)铁是26号元素,位于周期表中第四周期第ⅤⅢ族;
(2)分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO,反应生成Fe和CO,所以形成的化学键为金属键。
(3)原子数和价电子数分别都相等的是等电子体,则CO的一种常见等电子体分子为氮气,结构式为N≡N;CO分子中含有极性键,沸点高于氮气;CN-中C原子价层电子对个数=1+1/2(4+1-1×3)=2,所以采取sp杂化;一般来说非金属性越强,第一电离能大,但是因为p轨道半充满体系具有很强的稳定性.N的p轨道本来就是半充满的.O的p轨道失去一个电子才是半充满的,所以C、N、O三元素的第一电离能由大到小的顺序为N>O>C;
(4)①铜为29号元素,基态铜原子的核外电子排布式为[Ar]3d104s1或1s22s22p63s23p63d104s1;
②根据晶胞结构图可知,铜为面心立方堆积,所以每个铜原子周围距离最近的铜原子位于经过该原子的立方体的面的面心上,共有12个。
(5)根据价电子排布式判断出M原子为Cl原子,①由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子属于顶点与面心上,晶胞中含有Cl原子数目为8×1/8+6×1/2=4,所以化学式为CuCl;
②电负性差值大于1.7原子间易形成离子键,小于1.7原子间形成共价键,铜与Cl的电负性分别为1.9和3.0,差值为1.1小于1.7,形成共价键;
③一个晶胞的摩尔质量为4×99.5g/mol,根据m=p×V,则晶胞的摩尔体积为(4×99.5)÷p cm3,晶胞的边长为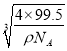 cm,根据晶胞的结构可知,铜原子和Cl原子之间的最短距离为立方体体对角线的1/4,而体对角线为晶胞边长的
cm,根据晶胞的结构可知,铜原子和Cl原子之间的最短距离为立方体体对角线的1/4,而体对角线为晶胞边长的![]() 倍,所以铜原子和Cl原子之间的最短距离为
倍,所以铜原子和Cl原子之间的最短距离为![]() ×
×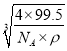 cm=
cm=![]() ×
×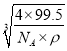 ×1010pm。
×1010pm。

【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
|
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团: |
(4)A的核磁共振氢谱如下图: |
|
| |





