题目内容
20.下列叙述正确的是( )| A. | Li的熔点高于Na的熔点 | |
| B. | CaF2晶体中Ca2+的配位数为4 | |
| C. | 干冰晶体中每个CO2分子周围距离相等且最近的CO2分子数为10个 | |
| D. | SiO2 的晶体中最小环上的原子个数为6个 |
分析 A、随着原子序数增大,碱金属单质的熔沸点逐渐降低;
B、在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子;
C、根据二氧化碳的晶胞图分析;
D、在二氧化硅晶体结构中,每个硅原子结合4个氧原子,同时每个氧原子结合2个硅原子.
解答 解:A、随着原子序数增大,碱金属单质的熔沸点逐渐降低,故锂的熔点高于钠的熔点,故A正确;
B、在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8,故B错误;
C、二氧化碳的晶胞图为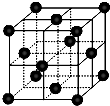 ,则干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个,故C错误;
,则干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个,故C错误;
D、二氧化硅晶体结构中,每个硅原子结合4个氧原子原子,同时每个氧原子结合2个硅原子原子,最小的环上,有6个Si原子和6个O原子,所以一共12个原子,故D错误.
故选A.
点评 本题考查了晶胞中离子个数的判断及配位数的计算,会利用均摊法确定晶胞中含有原子或离子的个数,难度较大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
8.下列反应的离子方程式书写正确的是( )
| A. | 硫酸铝溶液中加入过量氨水 Al3++30H-═Al(OH)3↓ | |
| B. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| C. | CuSO4溶液与少量的Ba(OH)2溶液:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O |
15.设NA表示阿伏加德罗常数数值,下列说法正确的是( )
| A. | NA个氢气分子所占的体积为22.4L | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | 1000mL0.1mol/L的NaCl溶液中,Na+和Cl-离子总数为0.2NA | |
| D. | 17g氨气中所含原子数为4NA |
5.下列说法正确的是( )
| A. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| B. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| C. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 | |
| D. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
12.在2NO2(g)?N2O4(g)的可逆反应中,下列状态属平衡状态的是( )
①υ正=υ逆≠0时的状态 ②NO2全部转变成N2O4的状态 ③C(NO2)=C(N2O4)的状态 ④N2O4不再分解的状态 ⑤混合物中,NO2的百分含量不再改变的状态 ⑥NO2的分子数与N2O4分子数的比值为2:1的状态 ⑦体系的颜色不再发生变化的状态.
①υ正=υ逆≠0时的状态 ②NO2全部转变成N2O4的状态 ③C(NO2)=C(N2O4)的状态 ④N2O4不再分解的状态 ⑤混合物中,NO2的百分含量不再改变的状态 ⑥NO2的分子数与N2O4分子数的比值为2:1的状态 ⑦体系的颜色不再发生变化的状态.
| A. | ①③④⑤⑥ | B. | ①⑤⑦ | C. | ②④⑤⑥ | D. | ①④⑤⑦ |
9.关于卤素(用X表示)的下列叙述中正确的是( )
| A. | 卤素单质与水反应的通式为X2+H2O?HX+HXO | |
| B. | HX都极易溶于水,它们的热稳定性随核电荷数增大而增强 | |
| C. | 卤素单质的颜色随相对分子质量增大的顺序而加深 | |
| D. | X-的还原性随卤素的核电荷数增大而增强,核电荷数小的卤素单质可将核电荷数大的卤素从它的盐溶液里置换出来 |
10.下列物质属于电解质的是( )
| A. | 酒精 | B. | 食盐水 | C. | 二氧化硫 | D. | 氯化钡 |
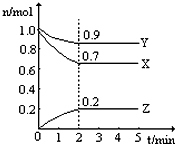 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: