题目内容
4.35 g二氧化锰能与浓盐酸(密度为1.19 g·cm-3、质量分数为36.5%)完全反应。求:
(1)盐酸中HCl的物质的量浓度。
(2)被氧化的HCl的物质的量。
(3)将所得气体全部用石灰乳吸收,可得到漂白粉的质量。
(1)11.9mol/L (2)0.1mol (3)6.35g (每小题2分,共6分)
解析试题分析:(1)设浓盐酸的体积为1L,则c(HCl)=1000ml×1.19g/cm3×36.5%÷36.5g/mol÷1L=11.9mol?L?1。
(2)根据化学方程式:MnO2+4HCl(浓) MnCl2+ Cl2↑+2H2O MnO2与被氧化的HCl物质的量之比为1:2, n(MnO2)=4.35g÷87g/mol=0.05mol,则被氧化的HCl为0.1mol。
MnCl2+ Cl2↑+2H2O MnO2与被氧化的HCl物质的量之比为1:2, n(MnO2)=4.35g÷87g/mol=0.05mol,则被氧化的HCl为0.1mol。
(3)n(Cl2)=n(MnO2)=0.05mol,根据反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,则漂白粉的质量为:0.025mol×111g/mol+0.025mol×143g/mol=6.35g。
考点:本题考查物质的量浓度与质量分数的换算、还原剂的量的计算及根据化学方程式的计算。

 小学教材全测系列答案
小学教材全测系列答案设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A.常温下,23g NO2含有NA个氧原子 |
| B.1 L 0.1mol?L-1的氨水含有0.1NA个OH― |
| C.标准状况下,22.4 L CCl4含有NA 个CCl4分子 |
| D.1molFe2+与足量的H2O2溶液反应,转移2NA个电子 |
下列化学用语书写正确的是
| A.氢气分子的电子式:H∶H |
B.硫原子的结构示意图: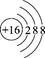 |
C.溴化钠的电子式: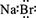 |
D.苯的分子式: |
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.CO2的电子式为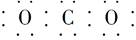 |
B.Cl-的结构示意图为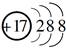 |
| C.乙烯的结构简式为C2H4 |
D.质量数为37的氯原子为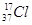 |
今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4 mol·L-1的FeCl3溶液(其它用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变):
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 100 | 100 | 100 | 100 |
| 混合粉末质量/g | 6 | 13.2 | 24 | 36 |
| 反应后剩余固体质量/g | 0 | 1.28 | 12.8 | 24.8 |
下列结论正确的是( )
A.第①组反应后溶液中c(Fe3+) =" 3.0" mol·L-1
B.第②组剩余固体是铜铁混合物
C.第④组反应后的滤液中c(Fe2+) =" 6" mol·L-1
D.原混合粉末中n(Fe)∶n(Cu) = 3∶2
下列有关化学用语表示和概念判断叙述正确的是
| A.1molH2燃烧放出的热量为H2的燃烧热 |
B.氢氧根离子的电子式: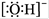 |
C.氯原子的结构示意图: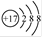 |
D. 和 和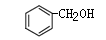 互为同系物 互为同系物 |
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1Ba(OH)2溶液300 mL(忽略溶液体积变化),反应后溶液中SO42-的物质的量浓度为
| A.0.4 mol·L-1 | B.0.1 mol·L-1 | C.0.2 mol·L-1 | D.0.3 mol·L-1 |