题目内容
将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液。试计算所得溶液中硫酸锌的物质的量浓度和质量分数各是多少?
所得溶液中硫酸锌的物质的量浓度为1.25mol/L,溶质质量分数为16.1%
解析试题分析:解:6.5gZn的物质的量为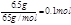 ,根据Zn元素可知生成的n(ZnSO4)=0.1mol,故Z所得溶液中ZnSO4的物质的量浓度为
,根据Zn元素可知生成的n(ZnSO4)=0.1mol,故Z所得溶液中ZnSO4的物质的量浓度为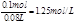 ;ZnSO4的质量为0.1mol×161g/mol=16.1g,溶液的质量为80mL×1.25g/mL=100g,故所得反应中硫酸锌的质量分数为
;ZnSO4的质量为0.1mol×161g/mol=16.1g,溶液的质量为80mL×1.25g/mL=100g,故所得反应中硫酸锌的质量分数为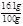 ×100%=16.1%,
×100%=16.1%,
答:所得溶液中硫酸锌的物质的量浓度为1.25mol/L,溶质质量分数为16.1%
考点:物质的量浓度的相关计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在标准状况下.0. 56g某气体的体积为448mL,则该气体的相对分子质量为
| A.2 | B.56 | C.14 | D.28 |
右图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是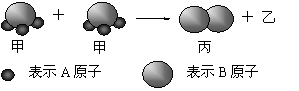
| A.化学反应中分子的种类发生了改变 |
| B.该反应类型是分解反应 |
| C.反应生成的丙物质属于单质 |
| D.根据阿佛加德罗定律可推知,1个乙分子中含有2个A原子 |
150℃时, NH4HCO3分解为NH3、H2O、CO2三种物质,此时混合气的密度是相同条件下的氢气密度的大约
| A.26.3倍 | B.15.25倍 | C.13.2倍 | D.12倍 |
配制100mL 2 mol/L的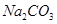 溶液,应称量
溶液,应称量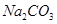 的质量为
的质量为
| A.21.2g | B.20.1g | C.212g | D.201g |
下列电子式书写正确的是
A. | B. | C. | D.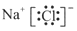 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1 molCl2与足量Fe反应转移电子数一定为3NA |
| B.标准状况下,2.24 L NH3中含有共价键的数目为NA |
| C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| D.标况下,11.2 L SO3所含的分子数目为0.5NA |
No为阿伏加德罗常数的值。下列叙述正确的是
| A.0℃、l0lkPa下,22.4L氦气含质子的数目为4No |
| B.常温常压下,14g氮气所含共价键数目为3No |
| C.25℃时,1LpH=13的Ba(0H)2溶液所含Ba2+数目为0.1 No |
| D.一定条件F.1.0 mol氯气与足量铁完全反应转移的电子数为2 No |