题目内容
13.氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如示意图所示,完成下列填空: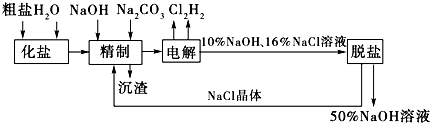
(1)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是ac.(选填a、b、c).
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(2)在电解过程中,与电源负极相连的电极上的电极反应式为2H++2e-═H2↑,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是淀粉碘化钾溶液.
(3)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发浓缩、冷却、
结晶过滤(填写操作名称)除去NaCl.
分析 (1)工业食盐中含有较多的Ca2+、Mg2+杂质,可以用试剂NaOH、Na2CO3除去,所以离子反应式为Ca2++CO32-=CaCO3↓,Mg2++2OH-=Mg(OH)2↓,如果含有SO42-,则可加Ba2+形成BaSO4白色沉淀;由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2;为了有效除去Mg2+、Ca2+和SO42-,必须先加钡试剂或NaOH,最后加入Na2CO3溶液,如果先加入Na2CO3溶液,后加BaCl2或Ba(OH)2,则多余Ba2+无法除去;
(2)电解NaCl溶液时,在与电源正极相连的电极上(阳极),Cl-失去电子生成Cl2:2Cl--2e-=Cl2;在与电源负极相连的电极(阴极)发生的反应为:2H++2e-=H2,消耗H+,产生OH-,所以附近的pH上升;检验氯气通常使用湿润的碘化钾淀粉溶液;
(3)经过一段时间的电解,NaCl溶液浓度在下降,NaOH溶液浓度在上升.当NaOH溶液质量分数变成10%,NaCl溶液质量分数变成16%时,停止电解,电解液加热蒸发,由于NaOH的溶解度大于NaCl,通过蒸发浓缩、冷却、结晶和过滤后可除去后经过滤除去NaCl,获得的NaCl可循环使用,据此进行解答.
解答 解:(1)除去粗盐中的SO42-,可加Ba2+形成BaSO4白色沉淀,由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2,故ac正确,
故答案为:ac;
(2)在电解过程中,与电源负极相连的电极为阴极,电解池中阴极氢离子得到电子生成氢气,电极反应式为:2H++2e-═H2↑;阳极氯离子失去电子生成氯气,氯气能够使淀粉碘化钾溶液变蓝,可用淀粉碘化钾溶液检验氯气,
故答案为:2H++2e-═H2↑;淀粉KI溶液;
(3)氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,则在温度高的时候,生成氢氧化钠晶体即可除去氯化钠,所以氢氧化钠和氯化钠分离的方法是:蒸发浓缩、冷却、结晶、过滤;
故答案为:浓缩;过滤.
点评 本题考查氯碱工业,题目难度中等,涉及电解原理、粗盐提纯、化学实验基本操作方法的应用等知识,明确发生的离子反应及电解反应原理是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序.

(1)A在周期表中的位置是第一周期第ⅠA族
(2)D、E、G三种元素均可形成简单离子,其半径由大到小的顺序为r(S2-)>r(O2-)>r(Na+)(用离子符号表示)
(3)B、F、G三种元素形成的最高价氧化物对应的水化物中酸性最强的物质是高氯酸(填物质名称); B、D、G三种元素形成的最简单气态氢化物中的沸点最高的物质是H2O(填化学式)
(4)A与B形成的所有化合物中,等质量时耗氧量最大的物质的分子构型为正四面体形
(5)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 仅由A和E两元素组成的离子化合物 |
| b | 由D和E组成的离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 化学组成为A2GD4 |
 ;
;②78g b中含有阴离子的物质的量为1mol;
③c的电子式为
 ;
;④单质B与d的浓溶液反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
| A. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| B. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| C. | 不慎将油汤洒在衣服上可用酒精、汽油等除去,它们能将油污从汤液中萃取出来而除去 | |
| D. | 玻璃是用石灰石,纯碱和二氧化硅等原料熔炼而成,在熔炼过程中发生了化学变化 |
| A. | 氢氧化钠与盐酸的反应 | B. | H+Cl→HCl | ||
| C. | 氯化铵与氢氧化钡晶体反应 | D. | 金属钠与水反应 |
| A. | 用pH试纸测氯水的pH | |
| B. | 用磨口玻璃瓶保存NaOH溶液 | |
| C. | 中和滴定时锥形瓶使用前需用待测液润洗 | |
| D. | 用CS2可除去试管内壁残留的S |
| A. | 37Cl中的37代表该原子的相对原子质量 | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 丙烷分子的比例模型: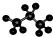 | |
| D. | 第三周期简单阴离子结构示意图均可表示为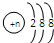 |
| A. | 向NaOH溶液中通入过量的CO2气体:CO2+2OH-═HCO3-+H2O | |
| B. | 过量氢氧化钙与碳酸氢镁溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | Fe3O4与稀硝酸反应:Fe2O3+8H+═Fe2++Fe3++4H2O | |
| D. | 偏铝酸钠溶液中加入过量盐酸:AlO2-+4H+═Al3++2H2O |
 .
. .
.