题目内容
9.有CO和H2的混合气体,将其完全燃烧,Na2O2固体增重3.2g,则原气体中CO和H2的体积比为( )| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 任意比 |
分析 CO和H2的混合气体完全燃烧分别生成CO2、H2O,2CO2+2Na2O2=2Na2CO3+O2,固体增加的质量相当于CO的质量;2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2↑,二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量,CO和H2的混合气体,将其完全燃烧,Na2O2固体增重3.2g,则增加质量为一氧化碳和氢气质量,据此分析解答.
解答 解:CO和H2的混合气体完全燃烧分别生成CO2、H2O,2CO2+2Na2O2=2Na2CO3+O2,固体增加的质量相当于CO的质量;2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2↑,二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量,CO和H2的混合气体,将其完全燃烧,Na2O2固体增重3.2g,则增加质量为一氧化碳和氢气质量,完全反应后过氧化钠增加质量与氢气和CO相对质量多少无关,所以二者体积之比为任意比,故选D.
点评 本题考查混合物的有关计算,侧重考查学生分析判断能力,明确过氧化钠和二氧化碳、水反应前后质量增加量成分是解本题关键,注意方法技巧的掌握和运用,题目难度不大.

练习册系列答案
相关题目
19. 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
( )
 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)| a | b | c | d | |
| ① | Si | SiO2 | H2SiO3 | Na2SiO3 |
| ② | N2 | NO | NO2 | HNO3 |
| ③ | Cu | CuO | Cu(OH)2 | CuSO4 |
| ④ | Na | NaOH | Na2CO3 | NaHCO3 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
20.可逆反应:A(g)+2B(g)═2C(g)△H=-Q kJ/mol.现有甲、乙两个容积相等且不变的密闭容器,向甲容器中充入1mol A和2mol B,在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol C,达到平衡后吸收的热量为Q2 kJ.已知Q1=9Q2,下列叙述中正确的是( )
| A. | Q1=Q | B. | 平衡时甲中C的体积分数比乙中小 | ||
| C. | 达到平衡时,甲中A的转化率为90% | D. | Q1+Q2>Q |
4.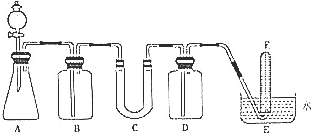 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
(1)填写表中空格:
(2)在上述某一装置中,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均相对分子质量为23.2
A.5.8 B.11.6 C.23.2 D.46.4
(3)试管F收集满气体后,下一步实验操作是把F中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气
(4)某人按下列方程测定样品中Na2O2的含量:称取一定量样品溶于足量的水,发生反应:Na2O2+2H2O=2NaOH+H2O2,2H2O2$\frac{\underline{\;NaOH\;}}{\;}$2H2O+O2↑,根据生成O2的量计算样品中Na2O2的纯度,他仔细实验过多次,得到的Na2O2含量均明显低于实际含量,这是因为B.
A.称量错误
B.H2O2分解不完全
C.Na2O2转化为H2O2和NaOH的反应不完全
D.装置漏气.
 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.(1)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2气体中混入的HCl |
| C | 石棉绒与过氧化钠 | 与CO2和水气反应,产生O2 |
| D | NaOH | 吸收未反应的CO2气体 |
A.5.8 B.11.6 C.23.2 D.46.4
(3)试管F收集满气体后,下一步实验操作是把F中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气
(4)某人按下列方程测定样品中Na2O2的含量:称取一定量样品溶于足量的水,发生反应:Na2O2+2H2O=2NaOH+H2O2,2H2O2$\frac{\underline{\;NaOH\;}}{\;}$2H2O+O2↑,根据生成O2的量计算样品中Na2O2的纯度,他仔细实验过多次,得到的Na2O2含量均明显低于实际含量,这是因为B.
A.称量错误
B.H2O2分解不完全
C.Na2O2转化为H2O2和NaOH的反应不完全
D.装置漏气.
14.将1.0g钠、铝混合物投人足量水中充分反应,则产生H2的物质的量为(已知Na、Al物质的量相等)( )
| A. | $\frac{10}{23}$mol | B. | 1mol | C. | $\frac{1}{46}$mol | D. | $\frac{1}{25}$mol |
1.实验室收集下列各组气体,选用相同方法的一组是( )
| A. | H2和HCl | B. | CO2和H2 | C. | CO2和HCl | D. | CO2和NH3 |
15.下列实验操作或做法正确的是( )
| A. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液小火加热蒸干 | |
| B. | 配制100ml1.00mol/L的NaCl溶液,需用托盘天平准确称量5.9g氯化钠固体 | |
| C. | 利用蒸馏的方法进行乙醇与水的分离时,温度计水银球应放在液面以下来准确测定温度 | |
| D. | 用浓硫酸配制一定物质的量的浓度的稀硫酸时,向浓硫酸中加水稀释,冷却至室温后才能够移到容量瓶 |