题目内容
18.计算0.1mol Al2(SO4)3跟350mL 2mol•L-1NaOH溶液混合,所得沉淀的质量为多少g?分析 n(NaOH)=2mol/L×0.35L=0.7mol,n(Al3+)=2n[Al2(SO4)3]=2×0.1mol=0.2mol,硫酸铝与氢氧化钠会发生反应:Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O,如果铝离子完全转化为沉淀需要0.6molNaOH,剩余0.1molNaOH溶解氢氧化铝沉淀,据此分析解答.
解答 解:1L 0.1mol/L的Al2(SO4)3溶液中n(Al3+)=1L×0.1mol/L×2=0.2mol
350mL 2mol/L NaOH溶液中n(OH-)=0.35L×0.2mol/L=0.7mol
n(Al3+):n(OH-)=0.2mol:0.7mol=1:3.5,介于1:4与1:3之间,故发生为:Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O,
令生成氢氧化铝的物质的量为xmol,则:
Al3++3OH-=Al(OH)3↓,
x 3x x
Al3++4OH-=AlO2-+2H2O,
0.2-x 0.7-3x
所以0.7-3x=4(0.2-x),
解得x=0.1,
故生成氢氧化铝的质量=0.1mol×78g/mol=7.8g,
答:生成沉淀的质量是7.8g.
点评 本题考查化学反应方程式有关计算,为高频考点,侧重考查学生分析计算能力,正确判断产物成分是解本题关键,注意关系式的灵活运用.

练习册系列答案
相关题目
8.不能用离子方程式 CO32-+2H+=CO2↑+H2O表示的反应是( )
| A. | Na2CO3+2HCl=2NaCl+CO2↑+H2O | B. | K2CO3+2HNO3=2KNO3+CO2↑+H2O | ||
| C. | K2CO3+H2SO4=K2SO4+CO2↑+H2O | D. | CaCO3+2HCl=CaCl2+CO2↑+H2O |
9.有CO和H2的混合气体,将其完全燃烧,Na2O2固体增重3.2g,则原气体中CO和H2的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 任意比 |
13.对金属铝的生产、氯碱工业和金属钠的生产的三个工业生产的描述正确的是( )
| A. | 电解法制铝时一般是用熔融的氧化铝进行电解,但也可用相应的盐,如熔融态的氧化铝 | |
| B. | 电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性 | |
| C. | 在氯碱工业中,电解池中的阳极产生的是Na0H和H2 | |
| D. | 氯碱工业和金属钠的生产中都用到了NaCl,在电解时它们的阴极都是Cl-失电子 |
3.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法不正确的是( )
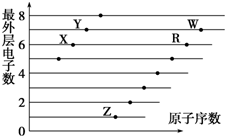

| A. | X和R在同一主族 | |
| B. | 含氧酸酸性:W>R | |
| C. | X与W可以形成酸性氧化物 | |
| D. | X、Z形成的化合物中可能含有共价键 |
4.下列各组离子能在溶液中大量共存的是( )
| A. | H+、Ca2+、NO3-、CO32- | B. | Fe3+、K+、OH-、SO42- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | K+、Na+、Cl-、NO3- |