��Ŀ����
ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������Ԫ�ص�ԭ������֮��Ϊ32�������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ�Y��Z�������ڣ�Z��Wλ��ͬ���壮
��1��WԪ�������ڱ��е�λ��Ϊ
��2����X��Z��Ԫ�ؿ������A��B���ֻ����A��һ�������¿��Էֽ��B��A�ķ�������
��3��һ�������£�Y�ĵ���������X�ĵ��������ַ�Ӧ����6.8g C���壨��֪n��X����n��Y��=3��1���ɷų�18.44kJ��������÷�Ӧ���Ȼ�ѧ����ʽΪ
��4����X��Y��Z��W����Ԫ����ɵ�һ�����ӻ�����D
����֪1mol D��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���壮д������������D��NaOH��Һ��Ӧ�����ӷ���ʽ
����֪D���������ᷴӦ����������ˮ��Ӧ��д��D����ˮ��Ӧ�����ӷ���ʽ
��5 ��X�ĵ�����Z�ĵ�����KOH��Ũ��Һ�п����γ�ԭ��أ�����Խ���M�ͽ���NΪ���Ե缫���ڵ�ص�M��ͨ��X�ĵ������壬N��ͨ��Z�ĵ������壬��M���ĵ缫��ӦʽΪ
��1��WԪ�������ڱ��е�λ��Ϊ
�������ڵ�V��A��
�������ڵ�V��A��
��д��YԪ��ԭ�ӵļ۵����Ų�ʽ��2S22P3
2S22P3
����2����X��Z��Ԫ�ؿ������A��B���ֻ����A��һ�������¿��Էֽ��B��A�ķ�������
����
����
������ԡ������Ǽ��ԡ������ӣ���3��һ�������£�Y�ĵ���������X�ĵ��������ַ�Ӧ����6.8g C���壨��֪n��X����n��Y��=3��1���ɷų�18.44kJ��������÷�Ӧ���Ȼ�ѧ����ʽΪ
N2��g��+3H2��g�� 2NH3��g����H=-92.2kJ/mol
2NH3��g����H=-92.2kJ/mol
 2NH3��g����H=-92.2kJ/mol
2NH3��g����H=-92.2kJ/molN2��g��+3H2��g�� 2NH3��g����H=-92.2kJ/mol
2NH3��g����H=-92.2kJ/mol
�� 2NH3��g����H=-92.2kJ/mol
2NH3��g����H=-92.2kJ/mol��4����X��Y��Z��W����Ԫ����ɵ�һ�����ӻ�����D
����֪1mol D��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���壮д������������D��NaOH��Һ��Ӧ�����ӷ���ʽ
NH4++OH-
H2O+NH3��
| ||
NH4++OH-
H2O+NH3��
��
| ||
����֪D���������ᷴӦ����������ˮ��Ӧ��д��D����ˮ��Ӧ�����ӷ���ʽ
SO32-+Cl2+H2O�TSO42-+2Cl-+2H+
SO32-+Cl2+H2O�TSO42-+2Cl-+2H+
����5 ��X�ĵ�����Z�ĵ�����KOH��Ũ��Һ�п����γ�ԭ��أ�����Խ���M�ͽ���NΪ���Ե缫���ڵ�ص�M��ͨ��X�ĵ������壬N��ͨ��Z�ĵ������壬��M���ĵ缫��ӦʽΪ
H2+2OH--2e-�T2H2O
H2+2OH--2e-�T2H2O
��������ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������Ԫ�ص�ԭ������֮��Ϊ32�������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ���XΪ��Ԫ�أ�Y��Z�������ڣ�Z��Wλ��ͬ���壬ԭ������Y��Z��W�������ߵ����λ��Ϊ ����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ�
����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ�
��1�����Ӳ��������������������������������������ݴ�Wȷ�������ڱ���λ�ã����ݺ�������Ų�������дYԪ��ԭ�ӵļ۵����Ų�ʽ��
��2��N2H4�����е�ԭ���뵪ԭ��֮���γ�N-N������ÿ��Nԭ�ӻ��γ�2��N-H����Nԭ����1�Թ¶Ե��Ӷԣ�Nԭ�ӵ��ӻ������Ϊ4��Nԭ�Ӳ�ȡsp3�ӻ���������������-NH2�ֱ�λ�����ƴ���ҳ��ҳ���ڣ�������������ƣ����Ӳ��Գƣ�
��3����������2molNH3�ų����������ٸ����Ȼ�ѧ����ʽ��дԭ����д��
��4����1mol D��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���壬������Ϊ���������ʵ���Ϊ2mol������DΪ���Σ���炙�������泥�
��D���������ᷴӦ����������ˮ��Ӧ����Ϣٿ�֪DΪ������泥�
��5��ԭ��ظ�������������Ӧ��������M���Ϸŵ磬���������£������ŵ�����ˮ��
 ����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ�
����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ���1�����Ӳ��������������������������������������ݴ�Wȷ�������ڱ���λ�ã����ݺ�������Ų�������дYԪ��ԭ�ӵļ۵����Ų�ʽ��
��2��N2H4�����е�ԭ���뵪ԭ��֮���γ�N-N������ÿ��Nԭ�ӻ��γ�2��N-H����Nԭ����1�Թ¶Ե��Ӷԣ�Nԭ�ӵ��ӻ������Ϊ4��Nԭ�Ӳ�ȡsp3�ӻ���������������-NH2�ֱ�λ�����ƴ���ҳ��ҳ���ڣ�������������ƣ����Ӳ��Գƣ�
��3����������2molNH3�ų����������ٸ����Ȼ�ѧ����ʽ��дԭ����д��
��4����1mol D��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���壬������Ϊ���������ʵ���Ϊ2mol������DΪ���Σ���炙�������泥�
��D���������ᷴӦ����������ˮ��Ӧ����Ϣٿ�֪DΪ������泥�
��5��ԭ��ظ�������������Ӧ��������M���Ϸŵ磬���������£������ŵ�����ˮ��
����⣺ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������Ԫ�ص�ԭ������֮��Ϊ32�������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ���XΪ��Ԫ�أ�Y��Z�������ڣ�Z��Wλ��ͬ���壬ԭ������Y��Z��W�������ߵ����λ��Ϊ ����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����XΪ��Ԫ�أ�YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ�
����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����XΪ��Ԫ�أ�YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ�
��1��WΪ��Ԫ�أ�ԭ�Ӻ�����16�����ӣ���3�����Ӳ㣬����������Ϊ6��λ�����ڱ��е������ڵ�V��A�壻 YΪ��Ԫ�أ�ԭ�Ӻ�����7�����ӣ���������Ų�ʽΪ1S22S22P3����ԭ�Ӽ۵����Ų�ʽ 2S22P3��
�ʴ�Ϊ���������ڵ�V��A�壻 2S22P3��
��2��XΪ��Ԫ�أ�YΪ��Ԫ�أ���X��Z��Ԫ�ؿ������A��B���ֻ����A��һ�������¿��Էֽ��B����AΪN2H4��BΪNH3��N2H4�����е�ԭ���뵪ԭ��֮���γ�N-N������ÿ��Nԭ�ӻ��γ�2��N-H����Nԭ����1�Թ¶Ե��Ӷԣ�Nԭ�ӵ��ӻ������Ϊ4��Nԭ�Ӳ�ȡsp3�ӻ���������������-NH2�ֱ�λ�����ƴ���ҳ��ҳ���ڣ�������������ƣ����Ӳ��Գƣ�Ϊ���Է��ӣ�
�ʴ�Ϊ�����ԣ�
��3��XΪ��Ԫ�أ�YΪ��Ԫ�أ�һ�������£�Y�ĵ���������X�ĵ��������ַ�Ӧ����6.8g C���壬�ɷų�18.44kJ������CΪNH3��6.8gNH3�����ʵ���Ϊ
=0.4mol����������2molNH3���ų�������Ϊ18.44kJ��
=92.2kJ����÷�Ӧ���Ȼ�ѧ����ʽΪN2��g��+3H2��g��  2NH3 ��g����H=-92.2 kJ/mol��
2NH3 ��g����H=-92.2 kJ/mol��
�ʴ�Ϊ��N2��g��+3H2��g�� 2NH3 ��g����H=-92.2 kJ/mol��
2NH3 ��g����H=-92.2 kJ/mol��
��4����X��Y��Z��W����Ԫ����ɵ�һ�����ӻ�����D����DΪ�����γɵ���λ��������γɵ���Σ�
��DΪ�����γɵ���λ��������γɵ���Σ�1mol D��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���壬������Ϊ���������ʵ���Ϊ2mol����DΪ����炙�������泥�����������D��NaOH��Һ��Ӧ�����ӷ���ʽΪNH4++OH-
H2O+NH3����
�ʴ�Ϊ��NH4++OH-
H2O+NH3����
��D���������ᷴӦ����������ˮ��Ӧ����Ϣٿ�֪DΪ������泥�Cl2��SO32-����ΪSO42-����������ԭΪCl-��
��Ӧ�����ӷ���ʽΪSO32-+Cl2+H2O�TSO42-+2Cl-+2H+��
�ʴ�Ϊ��SO32-+Cl2+H2O�TSO42-+2Cl-+2H+��
��5 ��������������KOH��Ũ��Һ�п����γ�ԭ��أ�����Խ���M�ͽ���NΪ���Ե缫���ڵ�ص�M��ͨ��X�ĵ������壬N��ͨ��Z�ĵ������壬ԭ��ظ�������������Ӧ���������ڸ����ŵ磬������Ӧ��ԭ��Ӧ���������������ŵ磬����M��ͨ������N��ͨ���������������£������ŵ�����ˮ����M���ĵ缫��ӦʽΪ H2+2OH--2e-�T2 H2O��
�ʴ�Ϊ��H2+2OH--2e-�T2 H2O��
 ����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����XΪ��Ԫ�أ�YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ�
����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����XΪ��Ԫ�أ�YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ���1��WΪ��Ԫ�أ�ԭ�Ӻ�����16�����ӣ���3�����Ӳ㣬����������Ϊ6��λ�����ڱ��е������ڵ�V��A�壻 YΪ��Ԫ�أ�ԭ�Ӻ�����7�����ӣ���������Ų�ʽΪ1S22S22P3����ԭ�Ӽ۵����Ų�ʽ 2S22P3��
�ʴ�Ϊ���������ڵ�V��A�壻 2S22P3��
��2��XΪ��Ԫ�أ�YΪ��Ԫ�أ���X��Z��Ԫ�ؿ������A��B���ֻ����A��һ�������¿��Էֽ��B����AΪN2H4��BΪNH3��N2H4�����е�ԭ���뵪ԭ��֮���γ�N-N������ÿ��Nԭ�ӻ��γ�2��N-H����Nԭ����1�Թ¶Ե��Ӷԣ�Nԭ�ӵ��ӻ������Ϊ4��Nԭ�Ӳ�ȡsp3�ӻ���������������-NH2�ֱ�λ�����ƴ���ҳ��ҳ���ڣ�������������ƣ����Ӳ��Գƣ�Ϊ���Է��ӣ�
�ʴ�Ϊ�����ԣ�
��3��XΪ��Ԫ�أ�YΪ��Ԫ�أ�һ�������£�Y�ĵ���������X�ĵ��������ַ�Ӧ����6.8g C���壬�ɷų�18.44kJ������CΪNH3��6.8gNH3�����ʵ���Ϊ
| 6.8g |
| 17g/mol |
| 2mol |
| 0.4mol |
 2NH3 ��g����H=-92.2 kJ/mol��
2NH3 ��g����H=-92.2 kJ/mol���ʴ�Ϊ��N2��g��+3H2��g��
 2NH3 ��g����H=-92.2 kJ/mol��
2NH3 ��g����H=-92.2 kJ/mol����4����X��Y��Z��W����Ԫ����ɵ�һ�����ӻ�����D����DΪ�����γɵ���λ��������γɵ���Σ�
��DΪ�����γɵ���λ��������γɵ���Σ�1mol D��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���壬������Ϊ���������ʵ���Ϊ2mol����DΪ����炙�������泥�����������D��NaOH��Һ��Ӧ�����ӷ���ʽΪNH4++OH-
| ||
�ʴ�Ϊ��NH4++OH-
| ||
��D���������ᷴӦ����������ˮ��Ӧ����Ϣٿ�֪DΪ������泥�Cl2��SO32-����ΪSO42-����������ԭΪCl-��
��Ӧ�����ӷ���ʽΪSO32-+Cl2+H2O�TSO42-+2Cl-+2H+��
�ʴ�Ϊ��SO32-+Cl2+H2O�TSO42-+2Cl-+2H+��
��5 ��������������KOH��Ũ��Һ�п����γ�ԭ��أ�����Խ���M�ͽ���NΪ���Ե缫���ڵ�ص�M��ͨ��X�ĵ������壬N��ͨ��Z�ĵ������壬ԭ��ظ�������������Ӧ���������ڸ����ŵ磬������Ӧ��ԭ��Ӧ���������������ŵ磬����M��ͨ������N��ͨ���������������£������ŵ�����ˮ����M���ĵ缫��ӦʽΪ H2+2OH--2e-�T2 H2O��
�ʴ�Ϊ��H2+2OH--2e-�T2 H2O��
����������ṹ��λ�ù�ϵ�����ӽṹ�뼫�ԡ�ԭ��ء��Ȼ�ѧ��Ӧ����ʽ�������ƶϵȣ��ۺ��Խϴ��Ѷ��еȣ��Ƕ�ѧ���ۺ������Ŀ��飬��ѧ��ȫ������֪ʶ��

��ϰ��ϵ�д�
�����Ŀ
 H2SO3��H2SO3
H2SO3��H2SO3 H++HSO3-
H++HSO3-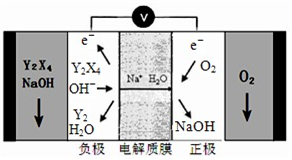
 X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪����X�ɷֱ���Y��W�γ�X2Y��X2Y2��XW�ȹ��ۻ������Z�ɷֱ���Y��W�γ�Z2Y��Z2Y2��ZW�����ӻ����
X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪����X�ɷֱ���Y��W�γ�X2Y��X2Y2��XW�ȹ��ۻ������Z�ɷֱ���Y��W�γ�Z2Y��Z2Y2��ZW�����ӻ����