题目内容
(14分)
(1)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)=2NO2(g) △H1=+68kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol
请写出该次发射火箭时燃烧反应的热化学方程式 。
(2)下表是不同温度下水的离子积数据:
若25<t1<t2,则a 1×10-14(填“>”、“<”或“=”);
t2℃下,某Na2SO4溶液中c(SO)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)= 。
(3)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的羟基磷灰石保护着,它在唾液中存在平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
已知Ca5(PO4)3F的Ksp=2.8×10-61,比Ca5(PO4)3OH质地更坚固。请写出当牙膏中配有氟化物添加剂后能防止龋齿的原因: 。(用离子方程式表示及简要的文字解释)
(4)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时, c(NO2)=0.50mol/L、c(N2O4)="0.125" mol/L。则2NO2(g) N2O4(g)的平衡常数K= 。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= 。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为 。
(1)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)=2NO2(g) △H1=+68kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol
请写出该次发射火箭时燃烧反应的热化学方程式 。
(2)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
t2℃下,某Na2SO4溶液中c(SO)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)= 。
(3)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的羟基磷灰石保护着,它在唾液中存在平衡:Ca5(PO4)3OH(s)
 5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。已知Ca5(PO4)3F的Ksp=2.8×10-61,比Ca5(PO4)3OH质地更坚固。请写出当牙膏中配有氟化物添加剂后能防止龋齿的原因: 。(用离子方程式表示及简要的文字解释)
(4)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时, c(NO2)=0.50mol/L、c(N2O4)="0.125" mol/L。则2NO2(g)
 N2O4(g)的平衡常数K= 。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= 。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为 。(1)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l) △H=-1136kJ/mol
(2)>; 100∶1
(3)有机酸长时间跟牙齿表面密切接触,使平衡向沉淀溶解的方向移动;
牙膏里的氟离子会与羟基磷灰石发生沉淀转化,生成氟磷灰石:
Ca5(PO4)3OH+F-===Ca5(PO4)3F+OH-
(4)0.50 L/mol 50%
(2)>; 100∶1
(3)有机酸长时间跟牙齿表面密切接触,使平衡向沉淀溶解的方向移动;
牙膏里的氟离子会与羟基磷灰石发生沉淀转化,生成氟磷灰石:
Ca5(PO4)3OH+F-===Ca5(PO4)3F+OH-
(4)0.50 L/mol 50%
(1)根据盖斯定律可知,②×2-①即得到2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l),所以反应热是△H=-534kJ/mol×2-68kJ/mol=-1136kJ/mol。
(2)电离是吸热的,所以随着温度的升高,水的离子积常数是增大,因此a>1×10-14;硫酸钠溶液显中性,所以c(OH-)=1×10-6 mol·L-1。溶液中c(Na+)=5×10-4 mol·L-1×2÷10=1×10-4 mol·L-1,所以c(Na+)∶c(OH-)==100︰1。
(3)由于有机酸长时间跟牙齿表面密切接触,使平衡向沉淀溶解的方向移动,所以牙齿就会受到腐蚀;由于Ca5(PO4)3F的Ksp小于Ca5(PO4)3OH的,所以牙膏里的氟离子会与羟基磷灰石发生沉淀转化,生成氟磷灰石,方程式为Ca5(PO4)3OH+F-===Ca5(PO4)3F+OH-。
(4)由于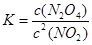 ,所以该温度下,K=
,所以该温度下,K= ;设NO2的最大转化率为x,则有
;设NO2的最大转化率为x,则有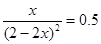 ,解得x=0.5,即转化率是50%。
,解得x=0.5,即转化率是50%。
(2)电离是吸热的,所以随着温度的升高,水的离子积常数是增大,因此a>1×10-14;硫酸钠溶液显中性,所以c(OH-)=1×10-6 mol·L-1。溶液中c(Na+)=5×10-4 mol·L-1×2÷10=1×10-4 mol·L-1,所以c(Na+)∶c(OH-)==100︰1。
(3)由于有机酸长时间跟牙齿表面密切接触,使平衡向沉淀溶解的方向移动,所以牙齿就会受到腐蚀;由于Ca5(PO4)3F的Ksp小于Ca5(PO4)3OH的,所以牙膏里的氟离子会与羟基磷灰石发生沉淀转化,生成氟磷灰石,方程式为Ca5(PO4)3OH+F-===Ca5(PO4)3F+OH-。
(4)由于
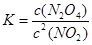 ,所以该温度下,K=
,所以该温度下,K= ;设NO2的最大转化率为x,则有
;设NO2的最大转化率为x,则有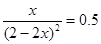 ,解得x=0.5,即转化率是50%。
,解得x=0.5,即转化率是50%。
练习册系列答案
相关题目
 SiF4 (g) + 2H2O(g),若该反应在恒温恒容的密闭容器中发生,不能判断反应已经达到化学平衡的是( )
SiF4 (g) + 2H2O(g),若该反应在恒温恒容的密闭容器中发生,不能判断反应已经达到化学平衡的是( ) CH3OCH3(g)+H2O(g)的平衡常数为400,此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400,此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下: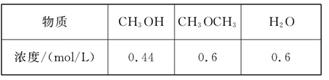
 2NH3的平衡体系中,保持容器的体积和温度不变,充入氩气以增大压强,此时下列叙述正确的是
2NH3的平衡体系中,保持容器的体积和温度不变,充入氩气以增大压强,此时下列叙述正确的是
 2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
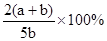
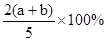
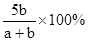
 pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是( )
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是( ) [CuCl4]2- +4H2O
[CuCl4]2- +4H2O ?nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
?nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答: