题目内容
某温度下,可逆反应2NO2  N2O4达平衡时,测得混合气体的密度是相同条件下氢气的36倍,求:
N2O4达平衡时,测得混合气体的密度是相同条件下氢气的36倍,求:
(1)此混合气体中NO2与N2O4的物质的量之比.
(2)若反应温度与容器容积不变,开始输进的是N2O4气,从逆向反应达平衡时,求N2O4的转化率.
 N2O4达平衡时,测得混合气体的密度是相同条件下氢气的36倍,求:
N2O4达平衡时,测得混合气体的密度是相同条件下氢气的36倍,求:(1)此混合气体中NO2与N2O4的物质的量之比.
(2)若反应温度与容器容积不变,开始输进的是N2O4气,从逆向反应达平衡时,求N2O4的转化率.
分析:(1)相同条件下,密度之比等于相对分子质量之比,由于混合气体的密度是相同条件下氢气的36倍,可知混合气体的平均相对分子质量为72,再根据十字交叉法计算NO2与N2O4的物质的量之比;
(2)为等效平衡,平衡时各组分的物质的量与原平衡相同,决定平衡时各组分的物质的量,利用三段式计算出开始应加入N2O4的物质的量,参加反应的N2O4的物质的量,再根据转化率的定义计算.
(2)为等效平衡,平衡时各组分的物质的量与原平衡相同,决定平衡时各组分的物质的量,利用三段式计算出开始应加入N2O4的物质的量,参加反应的N2O4的物质的量,再根据转化率的定义计算.
解答:解:(1)混合气体的密度是相同条件下氢气的36倍,所以混合气体的平均相对分子质量为36×2=72,
利用十字交叉法计算NO2与N2O4的物质的量之比:
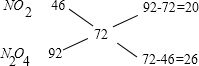
所以n(NO2):n(N2O4)=20:26=10:13,
答:混合气体中NO2与N2O4的物质的量之比为10:13;
(2)与原平衡完全等效,平衡时各组分的物质的量与原平衡相同.
平衡时混合气体中NO2与N2O4的物质的量之比为10:13,令NO2与N2O4的物质的量分别为10mol、13mol.
N2O4 2NO2
2NO2
开始(mol):13+5=18 0
变化(mol):5 10-0=10
平衡(mol):13 10
所以N2O4的转化率为
×100%=27.8%,
答:N2O4的转化率为27.8%.
利用十字交叉法计算NO2与N2O4的物质的量之比:

所以n(NO2):n(N2O4)=20:26=10:13,
答:混合气体中NO2与N2O4的物质的量之比为10:13;
(2)与原平衡完全等效,平衡时各组分的物质的量与原平衡相同.
平衡时混合气体中NO2与N2O4的物质的量之比为10:13,令NO2与N2O4的物质的量分别为10mol、13mol.
N2O4
 2NO2
2NO2 开始(mol):13+5=18 0
变化(mol):5 10-0=10
平衡(mol):13 10
所以N2O4的转化率为
| 5mol |
| 18mol |
答:N2O4的转化率为27.8%.
点评:本题考查化学平衡的计算,难度不大,(1)利用十字交叉法计算简化计算,十字交叉法用于解决二组分混合十分简便,注意理解运用.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
 N2O4达平衡时,测得混合气体的密度是相同条件下氢气的36倍,求:
N2O4达平衡时,测得混合气体的密度是相同条件下氢气的36倍,求: