题目内容
【题目】(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知: N2(g)+2O2(g)===N2O4(g) ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应生成氮气和气态水的热化学方程式:________________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施): ____________________。
(2)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)![]() 2NH3(g) △H=bkJmol﹣1,其化学平衡常数K值和温度的关系如下:
2NH3(g) △H=bkJmol﹣1,其化学平衡常数K值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
写出该反应的化学平衡常数的表达式: ,b 0(填“大于”、“小于”或“等于”)
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2) v逆(N2)(填“大于”、“小于”或“等于”)
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。

①c电极的名称为________,d电极上的电极反应式为______________________。
②如图2所示为用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为___________________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=__________(不考虑溶液体积变化) 。
【答案】(1)①2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 096.7 kJ·mol-1 (2分)
②高压、低温(或加压、降温) (2分)
(2)①K=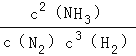 (2分) 小于(1分) ②小于(1分)
(2分) 小于(1分) ②小于(1分)
(3)①正极(1分)CH4-8e-+4O2-===CO2+2H2O(2分)
②4OH--4e-===2H2O+O2↑(2分) 1(2分)
【解析】
试题分析:(1)①a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJmol-1;b、N2H4(g)+O2 (g)=N2(g)+2H2O(g)△H=-543kJmol-1
依据盖斯定律b×2-a得到 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ/mol;
②四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮,由二氧化氮制取四氧化二氮,2NO2=N2O4,反应是放热反应,反应前后气体体积减小所以反应条件为:增大压强、降温都有利于反应正向进行;
(2)①N2(g)+3H2(g)![]() 2NH3(g)△H=bkJmol-1,平衡常数K=
2NH3(g)△H=bkJmol-1,平衡常数K=![]() ,由表中数据可知:平衡常数随温度升高而减小,说明升高温度,平衡逆向进行,逆向是吸热反应,故正反应为放热反应,故b小于0;
,由表中数据可知:平衡常数随温度升高而减小,说明升高温度,平衡逆向进行,逆向是吸热反应,故正反应为放热反应,故b小于0;
②400°C N2(g)+3H2(g)2NH3(g)的K=0.5,400℃时,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,浓度分别为3/0.5=6mol/L,2/0.5=4mol/L,1/0.5=2mol/L,Qc=![]() =1.1>K,说明平衡逆向进行,v正(N2)<v逆(N2);
=1.1>K,说明平衡逆向进行,v正(N2)<v逆(N2);
(3)①图1是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极甲烷是电子发生还原反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子,结合电子守恒写出电极反应为:CH4+4O2-=CO2+2H2O+8e-;
②如图2所示电解100mL0.5molL-1CuSO4溶液,发生的电解池反应为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,溶液中 氢氧根离子是电子发生氧化反应,电极反应为:4OH-=2H2O+O2↑+4e-;若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=0.01mol÷0.1L=0.1mol/L,PH=-lg0.1=1。
2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,溶液中 氢氧根离子是电子发生氧化反应,电极反应为:4OH-=2H2O+O2↑+4e-;若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=0.01mol÷0.1L=0.1mol/L,PH=-lg0.1=1。

【题目】钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).

已知:①物质溶解性:LiF难溶于水,CoCO3难溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)Ⅰ中得到钴渣的实验操作是 (填操作名称)。
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: .
(4)步骤Ⅲ中调节溶液的pH时, pH的范围是 。
(5)废渣中的主要成分有 .
(6)在空气中加热10.98g草酸钴晶体(CoC2O42H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
温度范围/℃ | 固体质量/g |
150~210 | 8.82 |
290~320 | 4.82 |
890~920 | 4.5 |
②加热到210℃时,固体物质的化学式为: .
③经测定,加热到210~310℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为: ..