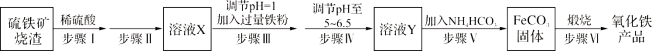题目内容
【题目】【化学—选修3:物质结构与性质】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外电子排布式为 。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为 。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属 分子(选填“极性”“非极性”),其立体构型为 。
(3)橙红色晶体羰基钴[Co2(CO)8]的熔点为52℃,可溶于多数有机溶剂。该晶体属于 晶体,三种元素电负性由大到小的顺序为(填元素符号) 。配体CO中σ键与π键数之比是 。
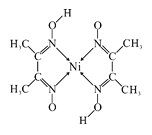
(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如上图所示,分子内的作用力不可能含有 (填序号)。
A离子键 B共价键 C金属键 D配位键 E氢键
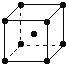
(5)钨为熔点最高的金属,硬度极大,其晶胞结构如图所示,已知钨的密度为ρ g·cm-3,则每个钨原子的半径r= cm。(只需列出计算式)
【答案】(1)[Ar]3d74s2(1分);sp2(1分);
(2)极性(1分);平面三角形(1分);
(3)分子(1分);O>C>Co(2分);1∶2(2分);
(4)AC(3分);(5)![]() ×
×![]() (3分)
(3分)
【解析】
试题分析:(1)Co的原子序数是27,则其基态钴原子的核外电子排布式为[Ar]3d74s2。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式与石墨中的相同,为sp2。
(2)已知甲醛各原子均满足稳定结构,其立体构型为平面三角形,但由于价格不对称,所以甲醛分子属极性分子。(3)橙红色晶体羰基钴[Co2(CO)8]的熔点为52℃,可溶于多数有机溶剂,这说明该晶体属于分子晶体。非金属性越强,电负性越大,因此三种元素电负性由大到小的顺序为O>C>Co。CO的结构和氮气相类似,所以配体CO中σ键与π键数之比是1∶2。
(4)根据结构示意图可知分子中存在共价键、配位键和氢键,但不能存在金属键和离子键,答案选AC。(5)根据钨晶胞结构图可知晶胞中含有1+8×1/8=2个原子。已知钨的密度为ρ g·cm-3,则晶胞的体积是![]() ,则晶胞的边长是
,则晶胞的边长是![]() ,因此每个钨原子的半径r=
,因此每个钨原子的半径r=![]() ×
×![]() cm。
cm。

 阅读快车系列答案
阅读快车系列答案