��Ŀ����
��֪2SO2��g����O2��g��![]() 2SO3��g������H��0��ʵ���������±���
2SO3��g������H��0��ʵ���������±���
| �¶� | ��ͬѹǿ��SO2��ת���ʣ�%�� | ||||
| 1��105Pa | 5��105Pa | 1��106Pa | 5��106Pa | 1��107Pa | |
| 450�� | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550�� | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
��1��Ӧѡ���¶��� ��
��2��Ӧ���õ�ѹǿ�� �������� ��
��3���ںϳɵ�SO3�����У�����Ҫ�����SO3��ԭ���� ��
��1��450�棻��2��1��105Pa ��Ϊ��ѹ��SO2��ת�����Ѿ��ܸߣ������ýϴ��ѹǿ��SO2��ת������ߺ��٣�����Ҫ���������豸��Ҫ����ߣ���3����ΪSO2��ת���ʱȽϸߣ��ﵽƽ���Ļ��������SO2���������٣��ʲ���Ҫ����SO3��
����:
��ҵ�����м�Ҫ���Ƿ�Ӧ���ʿ죬��Ҫ����ԭ��ת���ʸߣ�ͬʱҲҪ����ʵ�����������ơ������dz���ì��ʱ�����߶�Ҫ��ˣ��ر�Ҫ��Ӧ�����Ļ��ԡ��÷�Ӧ��ϳɰ����ƣ���ʵ������ֲ���ȫ��ͬ���ʽ���ʱӦ������ϵʵ�ʣ����ݺϳ�SO3��ʵ����������𡣸÷�Ӧ��ϳɰ��ķ�Ӧ���ƣ��������������С�ķ��ȷ�Ӧ���¶����������ڼӿ췴Ӧ���ʣ��������˷�Ӧ���ת���ʣ����˵�������ѡ����Ҫ�ۺϿ��ǡ�����ѹǿ�����ڼӿ췴Ӧ���ʣ�ͬʱҲ����˷�Ӧ���ת���ʣ���ѹǿ��SO2��ת����Ӱ�첻��ͬʱ��ѹ��Ҫ�������ء��豸��ѹ���أ��ۺϾ���Ч�棬���������в����ڳ�ѹ�½��������������SO2��ת���ʱȽϸߣ��ﵽƽ���Ļ��������SO2���������٣��ʲ���Ҫ����SO3��

 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�| 1 |
| 2 |
| A��+197.8kJ?mol-1 |
| B��+98.9kJ?mol-1 |
| C��-296.7kJ?mol-1 |
| D��-98.9kJ?mol-1 |
| ���� | �� | �� | �� | �� |
| ��ʼ������ | 2mol SO2+1mol O2 | 1mol SO2+0.5mol O2 | 2mol SO3 | 2mol SO2+2mol O2 |
| ��Ӧ�ų������յ�����/kJ | a | b | c | d |
| ƽ��ʱc��SO3��/mol?L-1 | e | f | g | h |
| A��a��2b��e��2f |
| B��a=c��e=g |
| C��a��d��e��h |
| D��c+98.3e=196.6 |
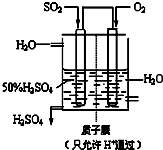
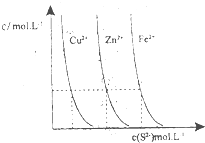 �����ǶԻ�ѧ��Ӧ�仯���̼�������о�����Ҫ��ش����⣺
�����ǶԻ�ѧ��Ӧ�仯���̼�������о�����Ҫ��ش����⣺