题目内容
有V、W、X、Y、Z五种元素,它们是核电荷数依次增大的前四周期元素;X、Z是金属元素;V和X元素原子的最外层电子都只有一个;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;Z是一种常见金属元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。由此可知:
(1)X在元素周期表中的位置是 ,Z的元素符号是
(2)V-W和V—Y属于极性共价键,其中极性较强的键是______(V、W、Y用元素符号表示)。
(3)w与X形成原子个数之比为1:1的化合物的电子式为
(4)工业上冶炼Z单质的化学方程式为
(1)X在元素周期表中的位置是 ,Z的元素符号是
(2)V-W和V—Y属于极性共价键,其中极性较强的键是______(V、W、Y用元素符号表示)。
(3)w与X形成原子个数之比为1:1的化合物的电子式为
(4)工业上冶炼Z单质的化学方程式为
(1)第三周期第IA族,Fe(2)H-O(3)略
(4)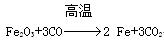
(4)

略

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
 D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:
D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:  ;W的质子数是X、Y、Z、M四种元素质子数之和的
;W的质子数是X、Y、Z、M四种元素质子数之和的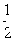 。下列说法正确的是
。下列说法正确的是
 案:
案:
 100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。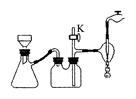
 反应的化学方程式:____________________________。
反应的化学方程式:____________________________。 (CN)2+2NaOH===NaCN+NaCNO+H2O
(CN)2+2NaOH===NaCN+NaCNO+H2O 、化学式回答下列问题:
、化学式回答下列问题: 2G(g)根据下表中的数据判断下列图像错误的是 。
2G(g)根据下表中的数据判断下列图像错误的是 。
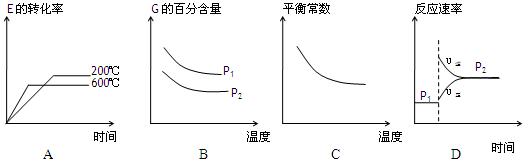 II下图为有机物CH3OH新型燃料电池,其中CH3OH由 极(填a或b)通入,写出下列条件下负极电极反应方程式。
II下图为有机物CH3OH新型燃料电池,其中CH3OH由 极(填a或b)通入,写出下列条件下负极电极反应方程式。