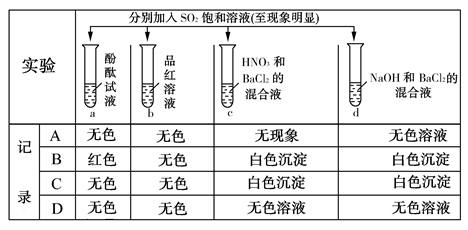
题目内容
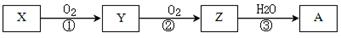
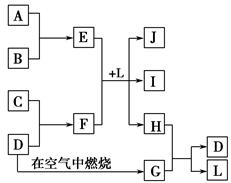
某硫酸厂废气厂SO2的回收利用方案如下图所示,下列说法不正确的是:


| A.X可能含有2种盐 | B.a是SO3 |
| C.Y可能含(NH4)2SO4 | D.(NH4)2S2O8中S元素的化合价不可能为+7 |
B
试题分析:A.将含有SO2的废气中通入氨水中,若气体少量,发生反应:SO2+2NH3+H2O=(NH4)2SO4,若气体足量,发生反应:SO2+NH3+H2O=NH4HSO4。故X可能含有2种盐。正确。B.向X中加入过量的H2SO4会发生反应产生SO2和NH4HSO4或(NH4)2SO4。SO2氧化得到SO3.SO3被浓硫酸吸收得到硫酸。因此B错误,C正确。由于S原子的最外层电子数为6个,所以在(NH4)2S2O8中S元素的化合价不可能为+7。正确。2的回收利用的工作原理的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
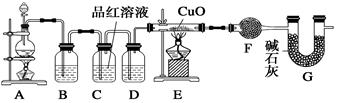
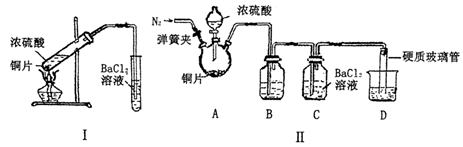
 ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。
ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。