题目内容
铜和浓硫酸发生反应的化学方程式为:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)浓H2SO4作______剂,具有______性.
(2)在该反应中,若消耗了32g Cu,则转移了______mol 电子,还原了______mol H2SO4,生成______ L SO2(标准状况)气体.
(3)以下三种物质的氧化性由强到弱的顺序为:______(写出序号)①浓H2SO4②稀H2SO4③CuSO4
(4)用双线桥表示铜和浓硫酸反应的电子转移方向和数目.Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O.
CuSO4+SO2↑+2H2O.
解:(1)该反应中,硫酸得电子化合价降低,所以硫酸是氧化剂,铜失电子作还原剂,氧化剂具有氧化性,
故答案为:氧化,氧化;
(2)设转移电子的物质的量是x,被还原的硫酸的物质的量是y,生成二氧化硫的体积是z
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 转移电子
CuSO4+SO2↑+2H2O 转移电子
64g 1mol(被还原) 22.4L 2mol
32g y z x
x=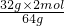 =1mol,
=1mol,
y= =0.5mol,
=0.5mol,
z=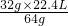 =11.2L,
=11.2L,
答:转移电子的物质的量是1mol,被还原的硫酸的物质的量是0.5mol,生成11.2L二氧化硫;
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O中浓硫酸的氧化性大于硫酸铜,铜离子得电子能力大于氢离子,所以硫酸铜的氧化性大于稀硫酸,所以三种物质的氧化性由强到弱的顺序为①>③>②,故答案为:①>③>②;
CuSO4+SO2↑+2H2O中浓硫酸的氧化性大于硫酸铜,铜离子得电子能力大于氢离子,所以硫酸铜的氧化性大于稀硫酸,所以三种物质的氧化性由强到弱的顺序为①>③>②,故答案为:①>③>②;
(4)该反应中,硫酸得电子数=1(6-4)=2,铜失电子数=1(2-0)=2,所以转移电子数是2,双线桥表示铜和浓硫酸反应的电子转移方向和数目 ,
,
故答案为: .
.
分析:(1)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,氧化剂具有氧化性;
(2)根据铜和转移电子、氧化剂硫酸、二氧化硫之间的关系式计算;
(3)同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(4)先计算转移电子数,再用双线桥表示铜和浓硫酸反应的电子转移方向和数目.
点评:本题考查氧化还原反应,易错题是(3),根据铜离子和氢离子得电子能力强弱来分析解答即可,为易错点.
故答案为:氧化,氧化;
(2)设转移电子的物质的量是x,被还原的硫酸的物质的量是y,生成二氧化硫的体积是z
Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O 转移电子
CuSO4+SO2↑+2H2O 转移电子64g 1mol(被还原) 22.4L 2mol
32g y z x
x=
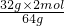 =1mol,
=1mol,y=
 =0.5mol,
=0.5mol,z=
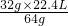 =11.2L,
=11.2L,答:转移电子的物质的量是1mol,被还原的硫酸的物质的量是0.5mol,生成11.2L二氧化硫;
(3)Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O中浓硫酸的氧化性大于硫酸铜,铜离子得电子能力大于氢离子,所以硫酸铜的氧化性大于稀硫酸,所以三种物质的氧化性由强到弱的顺序为①>③>②,故答案为:①>③>②;
CuSO4+SO2↑+2H2O中浓硫酸的氧化性大于硫酸铜,铜离子得电子能力大于氢离子,所以硫酸铜的氧化性大于稀硫酸,所以三种物质的氧化性由强到弱的顺序为①>③>②,故答案为:①>③>②;(4)该反应中,硫酸得电子数=1(6-4)=2,铜失电子数=1(2-0)=2,所以转移电子数是2,双线桥表示铜和浓硫酸反应的电子转移方向和数目
 ,
,故答案为:
 .
.分析:(1)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,氧化剂具有氧化性;
(2)根据铜和转移电子、氧化剂硫酸、二氧化硫之间的关系式计算;
(3)同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(4)先计算转移电子数,再用双线桥表示铜和浓硫酸反应的电子转移方向和数目.
点评:本题考查氧化还原反应,易错题是(3),根据铜离子和氢离子得电子能力强弱来分析解答即可,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O