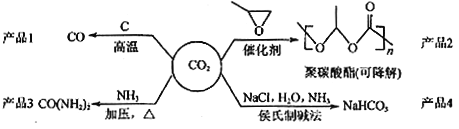
题目内容
【题目】A、B、C、D、E、F元素是原子序数依次增大的六种短周期元素。已知:元素A的原子半径在所有元素中最小,元素B的一种同位素可测定文物年代,D原子最外层电子数与核外电子总数之比为3∶4,E和D可以形成原子个数比为1∶1和 2∶1的两种离子化合物,F是同周期中简单离子中半径最小的元素。据此回答下列问题。
(1) F元素的原子结构示意图为________________,E在元素周期表中的位置为_______________。
(2) C元素与A元素形成一种离子CA![]() ,请写出检验溶液中存在该离子的实验操作、现象和结论: _____ ____。
,请写出检验溶液中存在该离子的实验操作、现象和结论: _____ ____。
(3) 写出F元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:___________________。
(4) 由以上某些元素组成的化合物X、Y、Z、W有如下转化关系(已知:Y和Z在水溶液中存在微粒种类相同)。
![]()
① X化合物中含有的化学键类型有__________________________;
② X+Z→Y的离子方程式为_____________________。
【答案】(1) ![]() 第三周期ⅠA族
第三周期ⅠA族
(2) 取少量溶液(或待测液)于试管中,滴加适量浓NaOH溶液后加热,将湿润的红色石蕊试纸粘在玻璃棒上靠近试管口,若试纸变蓝,说明溶液中存在该离子,反之,不存在该离子
(3 )Al(OH)3+OH-===AlO![]() +2H2O
+2H2O
(4) ① 离子键和共价键 ② OH-+HCO![]() ===CO
===CO![]() +H2O
+H2O
【解析】根据题意可推出A、B、C、D、E、F分别为H、C、N、O、Na、Al。
(2) CA![]() 为铵根离子。(4) 从X、Y、Z、W的转化关系以及Y和Z在水溶液中存在微粒种类相同,可以判断:W为CO2、X为NaOH、Y为Na2CO3、Z为NaHCO3。
为铵根离子。(4) 从X、Y、Z、W的转化关系以及Y和Z在水溶液中存在微粒种类相同,可以判断:W为CO2、X为NaOH、Y为Na2CO3、Z为NaHCO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=__________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为____________________;
b.该温度下,反应I的平衡常数K=______________。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
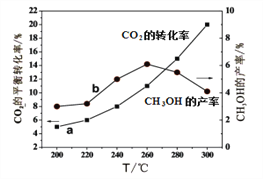
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________(填“增大”、“减小”、“不变”或“无法判断”)。