题目内容
【题目】下列物质中,不会发生水解的是
A. NaOH B. (NH4)2SO4 C. Na2CO3 D. FeCl3
【答案】A
【解析】根据盐类水解的规律,有弱才水解,A、属于强碱,不存在水解,符合题意,故A正确;B、硫酸铵属于强酸弱碱盐,NH4+发生水解,不符合题意,故B错误;C、碳酸钠属于强碱弱酸盐,CO32-发生水解,不符合题意,故C错误;D、FeCl3属于强酸弱碱盐,Fe3+发生水解,不符合题意,故D错误。

【题目】下列实验操作正确的是
A. 分液时,上下层液体均从下口放出
B. 蒸馏时忘记放碎瓷片可停止加热,冷却后补加
C. 蒸发结晶时,应将蒸发皿中的溶液全部蒸干
D. 过滤时,为加快过滤速度可搅拌漏斗内的液体
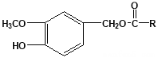
【题目】Ⅰ.制备水杨酸对正辛基苯基酯(![]() )的过程如下:
)的过程如下:
步骤一:将水杨酸晶体投入到三颈烧瓶中,再加入适量的氯苯作溶剂并充分搅拌使晶体完全溶解,最后加入少量的无水三氯化铝。
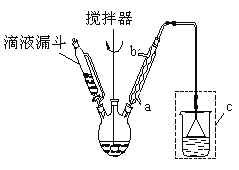
步骤二:按下图所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯。
该反应方程式为:
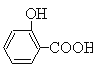 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→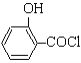 (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑
步骤三:将三颈烧瓶中混合液升温至80℃,再加入对正辛苯酚[![]() ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥即得产品。
(1)实验时,冷凝管中的冷却水进口为 _______(选填“a”或“b”);
(2)步骤一中加入无水三氯化铝的作用是 ___________________________。
(3)步骤三中发生反应的化学方程式为 _____________________________。
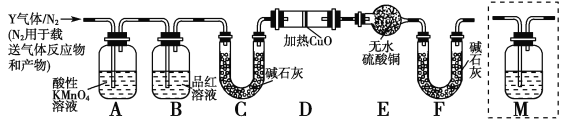
Ⅱ.PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 | |
白磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
已知下图是实验室制备PCl3的装置(部分仪器已省略),则:
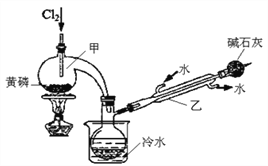
(1)实室制备Cl2的离子反应方程式为:________________。
(2)碱石灰的作用除了防止空气中的O2和水蒸气进入并与产品发生反应外还有:_________。
(3)向仪器甲中通入干燥Cl2之前,应先通入一段时间的干燥CO2,其目的是_____________。
(4)测定产品中PCl3纯度的方法如下:迅速称取m g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1 mol/L V1 mL 碘溶液,充分反应后再用c2 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗V2 mL Na2S2O3溶液。已知:H3PO3+H2O+I2==H3PO4+2HI;I2+2Na2S2O3==2NaI+Na2S4O6;假设测定过程中没有其他反应,则根据上述数据,求出该产品中PCl3的质量分数为 ___________________(用含字母的代数式表示、可不化简)。