题目内容
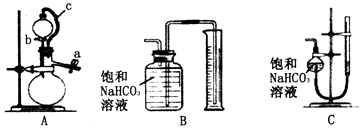
【题目】某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(夹持装置略,气密性已检验)如图所示。下列推断不合理的是

A. B中收集到的气体是氢气
B. 烧杯中双氧水溶液的作用是将Fe2+ 氧化为Fe3+
C. A中存在氧化铁与盐酸反应生成氯化铁的反应
D. 向反应后的烧杯中通入少量SO2,溶液颜色将立即由棕黄色变为浅绿色
【答案】D
【解析】A.铁和盐酸反应生成氯化亚铁和氢气,所以B中收集到的气体是氢气,选项A合理;B.双氧水具有氧化性,可将Fe2+氧化为Fe3+,选项B合理;C.氧化铁为碱性氧化物,可与盐酸反应生成氯化铁和水,选项C合理;D.向反应后的烧杯中通入少量SO2,SO2先与H2O2反应生成硫酸,溶液颜色不一定由棕黄色变为浅绿色,选项D不合理。答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目