题目内容
已知元素A、B、C、D、E的原子序数依次递增.A与D相邻,D元素的M层电子数是其K层电子数的2倍,C元素的最外层电子数是其电子层数的3倍,E的原子序数为29.请回答下列问题:
(1)下列有关说法正确的是
①D的单质常可制取光导纤维;
②DC2属于分子晶体;
③第一电离能:B>A>D
④基态E2+的核外电子排布式为:1s22s22p63s23p63d9
⑤BH3分子的空间构型为三角锥形
(2)与B2互为等电子体的分子为 ;
(3)A与氢原子形成的相对分子质量为28的化合物分子,A采取 杂化,且一个分子中有 个σ键;
(4)A、B两种元素形成的氢化物中,沸点较高的是 (填物质名称),其主要原因是 ;
(5)向含E2+的溶液中逐滴加入过量氨水时,可观察到 .
(1)下列有关说法正确的是
①D的单质常可制取光导纤维;
②DC2属于分子晶体;
③第一电离能:B>A>D
④基态E2+的核外电子排布式为:1s22s22p63s23p63d9
⑤BH3分子的空间构型为三角锥形
(2)与B2互为等电子体的分子为
(3)A与氢原子形成的相对分子质量为28的化合物分子,A采取
(4)A、B两种元素形成的氢化物中,沸点较高的是
(5)向含E2+的溶液中逐滴加入过量氨水时,可观察到
分析:元素A、B、C、D、E的原子序数依次递增.D元素的M层电子数是其K层电子数的2倍,则其M层电子数为4,故D为Si;C元素的最外层电子数是其电子层数的3倍,C原子只能处于第二周期,最外层电子数为6,则C为O元素;A与D相邻,A的原子序数小于O氧元素,则A、D为同主族元素,故A为碳元素;结合原子序数可知B为N元素;E的原子序数为29,则E为Cu,据此解答.
解答:解:元素A、B、C、D、E的原子序数依次递增.D元素的M层电子数是其K层电子数的2倍,则其M层电子数为4,故D为Si;C元素的最外层电子数是其电子层数的3倍,C原子只能处于第二周期,最外层电子数为6,则C为O元素;A与D相邻,A的原子序数小于O氧元素,则A、D为同主族元素,故A为碳元素;结合原子序数可知B为N元素;E的原子序数为29,则E为Cu,
(1)①二氧化硅由于制取光导纤维的,故①错误;
②SiO2属于原子晶体,故②错误;
③同周期自左而右元素的第一电离能呈增大趋势,同主族自上而下第一电离能降低,故第一电离能:N>C>Si,故③正确;
④Cu原子失去4s能级1个电子及3d能级的1个电子形成Cu2+,基态Cu2+的核外电子排布式为:1s22s22p63s23p63d9,故④正确;
⑤NH3分子的空间构型为三角锥形,故⑤正确,
故答案为:③④⑤;
(2)与N2互为等电子体的分子为CO,
故答案为:CO;
(3)碳原子与氢原子形成的相对分子质量为28的化合物为C2H4,C2H4分子中每个C原子成2个C-H、碳原子之间形成C=C双键,碳原子不含孤对电子,杂化轨道数目为3,故C原子采取sp2杂化,单键为σ键,双键含有1个σ键、1个π键,故一个分子中有5个σ键,
规答案为:sp2;5;
(4)A、B两种元素形成的氢化物分别为CH4、NH3,NH3分子之间存在氢键,氢键比范德华力更强,故NH3的沸点较高,
故答案为:氨气;NH3分子之间存在氢键,氢键比范德华力更强;
(5)向含Cu2+的溶液中逐滴加入过量氨水时,先反应生成氢氧化铜沉淀,氨水过量,再与氢氧化铜反应生成[Cu(NH3)4]2+配离子,可观察到:先产生蓝色沉淀,而后沉淀溶解得到深蓝色溶液,
故答案为:先产生蓝色沉淀,而后沉淀溶解得到深蓝色溶液.
(1)①二氧化硅由于制取光导纤维的,故①错误;
②SiO2属于原子晶体,故②错误;
③同周期自左而右元素的第一电离能呈增大趋势,同主族自上而下第一电离能降低,故第一电离能:N>C>Si,故③正确;
④Cu原子失去4s能级1个电子及3d能级的1个电子形成Cu2+,基态Cu2+的核外电子排布式为:1s22s22p63s23p63d9,故④正确;
⑤NH3分子的空间构型为三角锥形,故⑤正确,
故答案为:③④⑤;
(2)与N2互为等电子体的分子为CO,
故答案为:CO;
(3)碳原子与氢原子形成的相对分子质量为28的化合物为C2H4,C2H4分子中每个C原子成2个C-H、碳原子之间形成C=C双键,碳原子不含孤对电子,杂化轨道数目为3,故C原子采取sp2杂化,单键为σ键,双键含有1个σ键、1个π键,故一个分子中有5个σ键,
规答案为:sp2;5;
(4)A、B两种元素形成的氢化物分别为CH4、NH3,NH3分子之间存在氢键,氢键比范德华力更强,故NH3的沸点较高,
故答案为:氨气;NH3分子之间存在氢键,氢键比范德华力更强;
(5)向含Cu2+的溶液中逐滴加入过量氨水时,先反应生成氢氧化铜沉淀,氨水过量,再与氢氧化铜反应生成[Cu(NH3)4]2+配离子,可观察到:先产生蓝色沉淀,而后沉淀溶解得到深蓝色溶液,
故答案为:先产生蓝色沉淀,而后沉淀溶解得到深蓝色溶液.
点评:本题考查结构性质位置关系应用,涉及核外电子排布、电离能、分子构型、杂化轨道、化学键、元素化合物性质及用途等,难度不大,推断元素是解答关键,(5)中注意配离子的形成及相关离子方程式的书写.

练习册系列答案
相关题目
 和○代表两种不同的粒子.E与D形成的化合物的晶胞是下列中的
和○代表两种不同的粒子.E与D形成的化合物的晶胞是下列中的



 和
和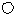 代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。