题目内容
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)烃A的分子式为_________。
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是_____;若总质量一定,充分燃烧消耗氧气的量不变的是____。
A. C7H8 B.C6H14 C.C7H14 D.C8H8
(3)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。
①A的结构简式为__________。
②链烃A与Br2的CCl4溶液反应生成B,写出由A生成B的化学方程式:_________
③与A互为同分异构体,且主链碳原子个数与A相同的链烃有_____种(不包括A)
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的所有碳原子是否在同一平面上__________。(是 否)
(5)如图:
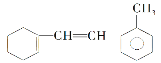
①该物质与足量氢气完全加成后环上一氯代物有________种;
②该物质和溴水混合,耗Br2的物质的量为_______mol;
③该物质和H2加成需H2________mol;判断下列说法不对的有________。
A.此物质可发生加成、取代、氧化等反应,不能发生加聚反应
B.和甲苯属于同系物
C.使溴褪色的原理与乙烯相同
D.能使酸性KMnO4溶液褪色是发生的加成反应
(6)按下列要求,回答问题:
如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
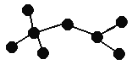
①用系统命名法命名________。
②M的二氯代物有________种。
③M是由某烯烃加成生成的产物,则该烯烃可能有_______种结构。
【答案】C6H12 A C ![]()
![]() + Br2→
+ Br2→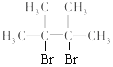 3 否 10 2 5 ABD 2,2,4-三甲基戊烷 11种 2种
3 否 10 2 5 ABD 2,2,4-三甲基戊烷 11种 2种
【解析】
(1)利用“商余法”计算烃A的分子式;
(2)根据烃燃烧通式![]() 计算。
计算。
(3)C6H12的不饱和度是1,分子中所有的碳原子在同一平面上,说明含有1个双键,一氯取代物只有一种,A分子中有1种等效氢;
(4)若C6H12不能使溴水褪色,说明不含双键,且其一氯代物只有一种,则A为环己烷;
(5)①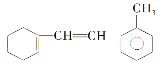 与足量氢气完全加成后的产物是
与足量氢气完全加成后的产物是![]() ;
;
②碳碳双键可与溴水发生加成反应;
③苯环、碳碳双键都能与H2发生加成反应;根据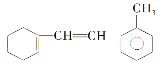 含有碳碳双键、苯环分析正误;
含有碳碳双键、苯环分析正误;
(6)①根据烷烃的系统命名原则命名;
②M有4种等效氢,根据“定一移一”的方法判断二氯代物的种类;
③根据碳原子能形成4个共价键分析烯烃的可能结构;
(1)烃A的相对分子质量为84,根据“商余法”,![]() ,所以烃A的分子中含有6个C原子、12个H原子,分子式是C6H12;
,所以烃A的分子中含有6个C原子、12个H原子,分子式是C6H12;
(2)根据![]() ,1mol C6H12燃烧消耗氧气9mol、1mol C7H8燃烧消耗氧气9mol、1mol C6H14燃烧消耗氧气9.5mol、1mol C7H14燃烧消耗氧气10.5mol、1mol C8H8燃烧消耗氧气10mol,总物质的量一定,充分燃烧消耗氧气的量不变的烃的分子式是C7H8,选A;C6H12中碳元素的质量分数是
,1mol C6H12燃烧消耗氧气9mol、1mol C7H8燃烧消耗氧气9mol、1mol C6H14燃烧消耗氧气9.5mol、1mol C7H14燃烧消耗氧气10.5mol、1mol C8H8燃烧消耗氧气10mol,总物质的量一定,充分燃烧消耗氧气的量不变的烃的分子式是C7H8,选A;C6H12中碳元素的质量分数是![]() 、C7H8中碳元素的质量分数是
、C7H8中碳元素的质量分数是![]() 、C6H14中碳元素的质量分数是
、C6H14中碳元素的质量分数是![]() 、C7H14中碳元素的质量分数是
、C7H14中碳元素的质量分数是![]() 、C8H8中碳元素的质量分数是
、C8H8中碳元素的质量分数是![]() ,C6H12、C7H14碳元素质量分数相同,总质量一定,充分燃烧消耗氧气的量不变的是C7H14,选C。
,C6H12、C7H14碳元素质量分数相同,总质量一定,充分燃烧消耗氧气的量不变的是C7H14,选C。
(3)C6H12的不饱和度是1,分子中所有的碳原子在同一平面上,说明含有1个双键,一氯取代物只有一种,A分子中有1种等效氢;
①A的结构简式为![]() 。
。
②链烃![]() 与Br2的CCl4溶液发生加成反应生成
与Br2的CCl4溶液发生加成反应生成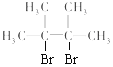 ,反应的化学方程式是
,反应的化学方程式是![]() +Br2→
+Br2→ ;
;
③A主链有4个碳原子、含有碳碳双键,与A互为同分异构体,且主链碳原子个数与A相同的链烃有CH2=C(CH3)CH(CH3)2、CH2=CHC(CH3)3、CH2=C(CH2CH3)2,共3种(不包括A);
(4)若C6H12不能使溴水褪色,说明不含双键,且其一氯代物只有一种,则A为环己烷,结构简式为:![]() ,环己烷有船式和椅式两种构象,不可能所有碳原子共面;
,环己烷有船式和椅式两种构象,不可能所有碳原子共面;
(5)①![]() 与足量氢气完全加成后的产物是
与足量氢气完全加成后的产物是![]() ,环上有10中不同环境的氢原子,该物质与足量氢气完全加成后环上一氯代物有10种;
,环上有10中不同环境的氢原子,该物质与足量氢气完全加成后环上一氯代物有10种;
②碳碳双键可与溴水发生加成反应,![]() 有2个碳碳双键,和溴水混合,耗Br2的物质的量为2mol;
有2个碳碳双键,和溴水混合,耗Br2的物质的量为2mol;
③苯环、碳碳双键都能与H2发生加成反应,![]() 和H2加成需H2 5mol;
和H2加成需H2 5mol;
A.![]() 含有碳碳双键,所以能发生加聚反应,故A错误;
含有碳碳双键,所以能发生加聚反应,故A错误;
B.含有碳碳双键,与甲苯结构不同,不属于同系物,故B错误;
C.![]() 含有碳碳双键,使溴褪色的原理与乙烯相同,都是发生加成反应,故C正确;
含有碳碳双键,使溴褪色的原理与乙烯相同,都是发生加成反应,故C正确;
D.能使酸性KMnO4溶液褪色是发生氧化反应,故D错误,选ABD;
(6)①根据烷烃的系统命名原则,![]() 的名称是2,2,4-三甲基戊烷;
的名称是2,2,4-三甲基戊烷;
②![]() 有4种等效氢,根据“定一移一”的方法,其二氯代物的种类有11种;
有4种等效氢,根据“定一移一”的方法,其二氯代物的种类有11种;
③烯烃与氢气加成时,碳骨架不变,碳原子能形成4个共价键,该烯烃可能有![]() 、
、![]() 两种结构。
两种结构。