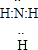题目内容
下列叙述正确的是
- A.当温度升高时,弱酸的电离平衡常数Ka变小
- B.某温度下的醋酸铵溶液呈中性,则溶液中必有c(H+)=c(OH-)=10-7mol·L-1
- C.pH=12氨水与pH=2盐酸等体积混合,则溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
- D.由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生
D
试题分析:A、电离是吸热的,所以当温度升高时,弱酸的电离平衡常数Ka变大,A不正确;B、某温度下的醋酸铵溶液呈中性,则溶液中必有c(H+)=c(OH-)。由于不能确定溶液的温度,所以二者的浓度不一定等于10-7mol/L,B不正确;C、氨水是弱电解质,存在电离平衡,所以pH=12氨水的浓度大于0.01mol/L,因此pH=12氨水与pH=2盐酸等体积混合,氨水过量,溶液显碱性,则溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),C不正确;D、氯化银的溶度积常数小于碘化银的溶度积常数,则根据沉淀容易向更难溶的方向转化可知,反应AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生,D正确,答案选D。
考点:考查外界条件对电离平衡的影响;溶液酸碱性判断、溶液中离子浓度大小比较以及溶解平衡的应用
试题分析:A、电离是吸热的,所以当温度升高时,弱酸的电离平衡常数Ka变大,A不正确;B、某温度下的醋酸铵溶液呈中性,则溶液中必有c(H+)=c(OH-)。由于不能确定溶液的温度,所以二者的浓度不一定等于10-7mol/L,B不正确;C、氨水是弱电解质,存在电离平衡,所以pH=12氨水的浓度大于0.01mol/L,因此pH=12氨水与pH=2盐酸等体积混合,氨水过量,溶液显碱性,则溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),C不正确;D、氯化银的溶度积常数小于碘化银的溶度积常数,则根据沉淀容易向更难溶的方向转化可知,反应AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生,D正确,答案选D。
考点:考查外界条件对电离平衡的影响;溶液酸碱性判断、溶液中离子浓度大小比较以及溶解平衡的应用

练习册系列答案
相关题目
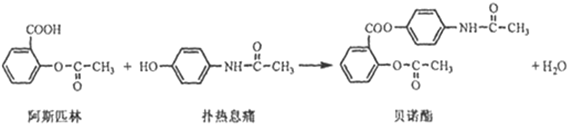
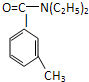 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH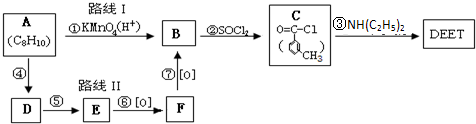


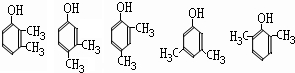 (任写2种)
(任写2种)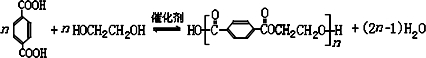

 NH3?H2O+H+
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.